苹果
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第596页(12731字)
Brown(1975)评论了苹果的历史、来源和早期发展。栽培苹果是Malus各种间互交的结果,最常用的名称有M.pumila Mill.,M.sylvestris Mill.与M.domestica Borkh。
苹果祖先原产于东西欧和西南亚。希腊与罗马人栽培苹果以来,几千年从野生型选择。13世纪才有栽培品种的命名。至少2000年已用切芽或嫁接无性繁殖。早期殖民者把栽培苹果引入北美,常用种子繁殖。选得适应于新条件的需要类型后,又用营养繁殖。
(一)研究进展
1.微繁殖方法的发展 组织培养繁殖是实生苹果树繁殖合理方法,一是具有大量繁殖潜势,二是常规切枝繁殖困难。Sones(1967),Pieniazek(1968),Elliot(1972)分别用砧木M.26和M.7,5周龄幼苗茎尖到老苗休眠芽和大田Granny Smith成年树茎尖人工培养,证明BA促进茎尖、侧芽生长,但对芽增生无效。Elliot用BA或ZEA观察到多叶芽,KIN无效。也未见生根。茎尖在对照培养基上,有时生根,根尖也生长,虽不如用BA的。幼苗休眠腋芽人工培养生芽,有BA时,形成丛芽。Walkey(1972)用幼苗,Quorin(1974)用M.26砧木分生组织再生植株,生根前未见芽的增殖。加聚乙烯吡咯烷酮(PVP)液培最初.4-8周,是消除氧化酚化学物抑制分生组织顶尖生长所需。但最近研究指出PVP在成功启动培养体是不必要的。
Abbott与Whiteley(1976)取得了苹果芽人工培养增殖和芽生根。取Cox′s Orange Pippin的幼苗和温室成年树分生组织尖,培养在MS加简化有机成分,无生长素,加KIN0.5-4.6μM。形成了芽丛,从中取个别芽反复继代。成年外植体只从腋芽增殖,幼苗外植体则从基部愈伤组织产生腋芽和不定芽。KIN0.5μM以上和23.0μM以上未能诱导芽增殖。加IBA培养基上,二者都能生根,但结果不一致。以后大多数研究用BA为细胞分裂素。Jones(1976)报道根皮苷(PZ)和间苯三酚(PG)对M.7与M.26砧木芽增殖有突出效应。改进的MS+BA与IAA发生芽增殖,除去IAA增殖中止,加PZ或PG芽数、长和重增大。当把这些芽转移到无细胞分裂素培养基上,易于生根。Jones与Hatfield(1976)指出PG与根皮酸与生长素配合,M.7芽生根数加倍,而邻苯三酚、咖啡酸和茶儿酚无效。IBA 5μM效果最好。这构成Jones等(1977)用于M.26砧木微繁殖的第一种完整体系,也适用M.27砧木。
以后研究扩大到许多砧木与接穗栽培品种。Muth(1978)发现8.9μMBA和1.1μM NAA对Jonathan很小分生组织(0.2mm)培养最好,但芽最适生长NAA要降低到0.3μM。5.4或54.0μM生长素生根达70%,加0.3μM GA3有所改进。生长素低于5.4μM未能生根。但0.5-1.5μMIBA或0.5-1.6μM NAA生根达90%以上。Lane(1978)建立了活跃生长芽和休眠芽Macsqur分生组织培养物。NAA与GA3和离于或低于5μMBA降低芽增殖。将芽培养在NAA培养基上启动后,转移到无生长调节剂培养基上,促进根发育。低于28℃也降低生根。用 液基加真珠岩∶蛭石(1∶1)支持,Spartan,Ozaik,Gold和MM106生长较好,与琼脂培养基相比。这种技术在有、无IBA时都能生根。
液基加真珠岩∶蛭石(1∶1)支持,Spartan,Ozaik,Gold和MM106生长较好,与琼脂培养基相比。这种技术在有、无IBA时都能生根。
Jones等(1979)发现间苯三酚(PG)促进另5个栽培品种生根。其作用是直接影响芽增殖和生根,或间接影响培养体的细菌污染未预测定。PG也能促进砧木M.9生根。在增殖期,生长在PG上的培养物生根较好,芽增殖虽无改进。切枝在含有IBA与PG培养基上4天,然后转移到无生长调节剂培养基上,生根最好。IBA最适浓度为14.8μM与PG 10mM。M.9二个系的生根不同,并能在几次继代中保持这些差异。
Lundergan与Janick(1980)研究了Golden Delicious培养物芽增殖受不同细胞分裂素的促进作用。BA最有效,2ip最差,KIN中间,但对芽伸长影响顺序相反。BA最有效浓度(13.2-22.2μM)产生的芽是粗短的。经转移到含2ip或4.4μM BA加4.9μM IBA培养基取得正常生长。
M.7外植体建成和芽增殖在 加2.2μM BA易于建成。
加2.2μM BA易于建成。 加4.9-14.8μM IBA加0.27%软琼脂培养基上芽易于生根(Snir与Erez 1980)。相反,Snir与Erez(1980)采用了Jones等(1977)培养基不加PG。将液培放在轨道振荡器上4天,芽无增殖。转移到不加IBA但加活性炭生根培养基的芽,消除了IBA的二种附从的影响:根切段基部长愈伤组织和抑制芽生长。用刀片切伤芽基部,似能增多其生根。Sriskandarajah与Mullins(1981)用Granny Smith栽培品种在液培不加振荡中取得了充分生根(80%比0-4%)。
加4.9-14.8μM IBA加0.27%软琼脂培养基上芽易于生根(Snir与Erez 1980)。相反,Snir与Erez(1980)采用了Jones等(1977)培养基不加PG。将液培放在轨道振荡器上4天,芽无增殖。转移到不加IBA但加活性炭生根培养基的芽,消除了IBA的二种附从的影响:根切段基部长愈伤组织和抑制芽生长。用刀片切伤芽基部,似能增多其生根。Sriskandarajah与Mullins(1981)用Granny Smith栽培品种在液培不加振荡中取得了充分生根(80%比0-4%)。
Zimmerman与Broome(1981)评价了PG对许多苹果接穗栽培品种生根影响(表24-1)。
表24-1 栽培品种PG与IBA对6个苹果栽培品种组织培养再生芽在四周后生根百分数的影响2

a.Zimmerman与Broome,1981。
b.-PG=0mg/l;+PG=162mg/l(10-3M)。
再者,用Spartan不同外植体的早期测验,用PG并未见有利。高压蒸气消毒不改变PG生根影响。但是,PG对在含4.9μMIBA培养基上生长四周的切口基部的愈伤组织形成确有所降低。最近,发现1mMPG(162mg/1)生根培养基加强了Delicious与Redspur芽的生根,而Gala则以在无PG培养基生根前,增殖培养基加1mMPG能多少促进其生根。
Welander与Huntrieser(1981)用成年砧木A2为芽培养,在5μMIBA下,1mMPG抑制生根,0.1μMPG则有促进;幼年植株的芽,二种PG对生根都有改进。在全部供试IBA浓度下,1mMPG使切枝的愈伤组织形成减少。
Sriskandaraiah等(1982)比较在连续光照90-100μEm-2s-1,26℃与生长在16h光照,20-30μEm-2s-1,23℃的Janathan与Delicious增殖培养体的切枝生根,发现以前者为好。生根百分数与根数随继代培养次数增多而增高,如Jonathan第一次继代切枝生根,第9次后95%。Delicious生根第一次继代后为15%,31或更多次继代后达70%以上。与继代次数增多的同时,增殖芽上的叶形改变,芽直径减小,可能表现出组织的还童。以后继代中,这些变化与切枝生根增多相关。
Nemeth(1981)测验了几种合成生长素诱导生根的效果,报导2-氯-3-(2,3二氯苯)丙酸腈对促进M.26,M.27,MM.104与Stark Spur(或Starkspur Red Delicious)生根比IBA更有效。最好浓度是5μM。但是,与其他学者用相同砧木栽培品种相比较,IBA达到的生根百分较低。
关于环境条件的影响很少研究,似以光强比光质较受注意。Standari(1979)比较不同光周期、光强和光源对M.26增殖和生根的效果。二者均以16比12h光周期为好。3100lx(40W Sylvenia Lifeline Gro-lux灯管)和7600lx(Phillips TL40W/33灯管)最好,后者对根数作用较差。每切枝生根数与光强呈反相关,根长为正相关,可能由于形成的根数较少。从约50μEm-2s-1增强到420μEm-2s-1Jonathan切枝生根百分减少一半,每切枝根数也复如此。Lin等(1978)用茎尖暗培在MS培养基上取得许多砧木和幼苗培养体。培养启动后,放到低光下1周,使黄化芽变绿。再把移至暗培几个月;将黄化芽切成含1-2芽的切段,移放光(3000-5000lx)培,以供增殖。用此测验生根。暗与光培交替,增高增殖率和芽的一致性。
增殖培养物黄化2周,继之低光强(1000lx)几天(使之返绿),Seprem Red Deli-cious生根百分从2%增至53%,Wellspur Delicious从10→82%。许多情况下,黄化不转绿的,在茎尖近处形成愈伤组织,继之茎尖脱落。返绿时间增长到8天,茎尖脱落现象消除了。虽然有些茎尖脱落的切枝,有时生根和被驯化,但在温室生长不好。一般言之,黄化切枝弱,难于驯化。Gala,Matsu(Crispin),Delicious,和Redspur Delicious增殖培养物黄化转绿切枝生根结果相同但程度较低。Delicious与Redspur Delicious脱落严重,Gala与Mutsa稍好。
1977年以来,商业组织培养实验室生产苹果砧木和少数苹果插穗栽培品种数量大有增加。许多情况下,这类工作包括适应和改进已有方法。可见苹果微繁殖方法研究已做了很多工作。
2.不定芽 Abbott与Whiteley(1976)从Cox′s Orange Pippin幼苗外植体基部看到不定芽产生。最近,砧木M.26继代芽从愈伤组织基部产生不定芽。砧木M.27叶在增殖培养体中直接长出不定芽。
3.愈伤组织器官建成 幼发育中苹果种子胚乳培养在MS+水解酪蛋白加4.6μmKIN和2.3μM 2,4-D诱导形成愈伤组织。当转移到MS+BA和NAA,66天内发育成再生植株。愈伤组织上分化根和叶。砧木M.9也从愈伤组织再生植株。从培养在MS加2.2μMBA,10.7μMNAA和100mg/l水解酪蛋白(CH)的茎切段产生愈伤组织,转移到不加NAA的MS,在愈伤组织瘤状分化芽。移至MS+IBA生根。Golden Delicious幼苗各部分产生的愈伤组织培养体再生叶、芽和根(Mehra),使之生根取得植株。
4.体细胞胚胎发生 Golden Delicious发育中种子分离珠心组织,分成珠孔和合点各半,暗培在无生长调节剂MS上。有些珠孔端的珠心部分产生少数不定胚。用之再暗培,在子叶上形成格外胚状结构。但无见长到成熟。
(二)微繁殖程序
1.从活跃生长中芽建成外植体 从温室或大田生长苹果幼苗取3-5cm活跃生长茎尖,放入塑料袋以防萎蔫,移至试验室。除去茎上的叶,仔细除托叶,不伤腋芽,除撕去基皮。尽可能剥去茎尖外围的卷叶。剥取的芽放入蒸馏水容器中,每100m1加2滴清洁剂,加40个芽。用磁棒轻搅5min,把水倒去。用蒸馏水淋芽3次,除去残屑。每升蒸馏水加次氯酸钙60g,搅动15min,残渣下沉后,真空过滤,制成饱和母液。用蒸馏水稀释一倍,加0.01%吞温20,轻度搅30min。在超净台上排去次氯酸钙,无菌蒸馏水稍加淋芽,随之第二次淋搅5分钟。芽放入新鲜无菌蒸馏水备用。芽放在无菌皿或表面上,在节下切成最后长1-2cm,放入125ml欧氏三角瓶,装15ml改进MS液基(培养基见表24-2),用铅箔封口。培养物放在平面板上,连续转动1rpm,2-4天,室温26℃。16h光照,50-70μEm-2s-1这种方法能快速检测细菌和真菌污染,淋洗外植体上的酚类化合物,和为外植体与培养基间提供最大接触。外植体转移到同成分固体培养基上。外植体生长比在固体培养基启动的为好。
通常培养7-10天开始顶芽和侧芽生长。3周,取外植体时存在的叶原基发育成长,不卷叶,有时把外植体推离培养基。把叶除去,外植体转移到新鲜培养基。以后每3-4周转一次,必要时分开新产生的芽。
Jones等(1977,1979)提出另几种方法。茎尖2-4cm收集在蒸馏水中,蘸入0.0l%湿液剂中,用次氯酸钠(0.14%w/v有效氯)1min,无菌蒸馏水洗3次。茎尖接种在MS盐类、糖和琼脂上过夜,再次蘸入湿液剂,继之次氯酸钙溶液(0.42%w/v有效氯)40min。蒸馏水淋洗3次后,从茎尖解剖出顶端1-2cm片段,移入MS。这种方法常用于早先冷藏植株破芽时立即取的茎尖。从大田生长树上取茎尖,用流动自来水洗1h,浸入次氯酸钠40min。
Lane(1978)将茎尖蘸70%乙醇5s或30s,从顶芽和侧芽解剖取0.2-0.5mm分生组织顶尖,带1-2叶原基。
2.从芽建立外植体 满足休眠期后收集大田植株的休眠芽,或提早收集冷藏几个月后备用。将芽切成长2-4cm,在远端带芽。浸入95%乙醇,每100m1加一滴吐温20,磁棒搅10min。倒去乙醇,换以饱和次氯酸钙溶液(60g/l配法如上)含吐温20 0.01%。常速搅动20min后,无菌蒸馏水淋洗茎切段5分钟,再次常速搅动。放入新鲜无菌蒸馏水备用。
顺序将芽鳞片和叶原基除去,露出生长点。把带几个叶原基的生长点接种,其基部接触培养基表面,培养基是改进的Lepoivre含0.4μM BA和0.05μM IBA。接种在玻璃试管内的斜面培养基上。
培养3-4周,分生组织尖外植体长成小芽,6-8周,短芽上长出充分发育的叶簇。将外植体移至MS增殖培养基,与活跃生长茎尖同样处置。
British Columbia商业公司实验室采用经重要修改的同样方法。早秋收集芽穗,芽切成长约2-4cm的一个节的小段。除去芽周围的树皮,和外层芽鳞。从茎段上切带有5mm延伸木的芽,放入蒸馏水。积至30芽时,换以次氯酸钠(0.8-1.2%活化氯)10-15min。浓度和处理时间视材料而定。无菌蒸馏水淋洗芽,放入无菌培养皿中。取4个芽,放入另一无菌培养皿,进行顺序解剖。用镊子夹住木材基部,保持朝上。用解剖刀顺叶序排列削去绿色芽鳞和叶,直至只余下分生组织尖和2-4叶原基。放在载玻片上,修切,做基,分生组织尖接着在小残基上,插入MS+2.2-4.4μM BA中。
Sriskandaraiah等(1982)最近描述不用解剖的芽建立外植体技术。从温室生长植株长到长约40cm直径5mm时收集芽,除去叶,芽切成长8-10cm小段。用次氯酸钠溶液(1%有效氯)加0.05%吞温20,振荡15min表面消毒。无菌蒸馏水淋洗几次后,将带节的小段接种25mm直径试管内,装15ml培养基。MS+8g琼脂,87.5μM蔗糖和10μM BA。当将之培养在26℃连续光照(冷白荧光管)(90-100μEm-2s-1)时,约1周内芽暴破,约2周内芽伸展生长。
3.增殖 一旦建成培养物,芽在改进的MS(表24-2)+4.4μM BA,0.5+4.9μM IBA,和1.5μM GA3增殖。将从活跃生长的芽新产生的尖平放在培养基上,稍埋在琼脂中。另一方法,采用木本植物培养基(WPM)。增殖开始期生长旺盛,增殖率较MS为好,但用WPM组织透明化是大问题。
表24-2 用于苹果栽培品种建成、增殖和生根的培养基成分2
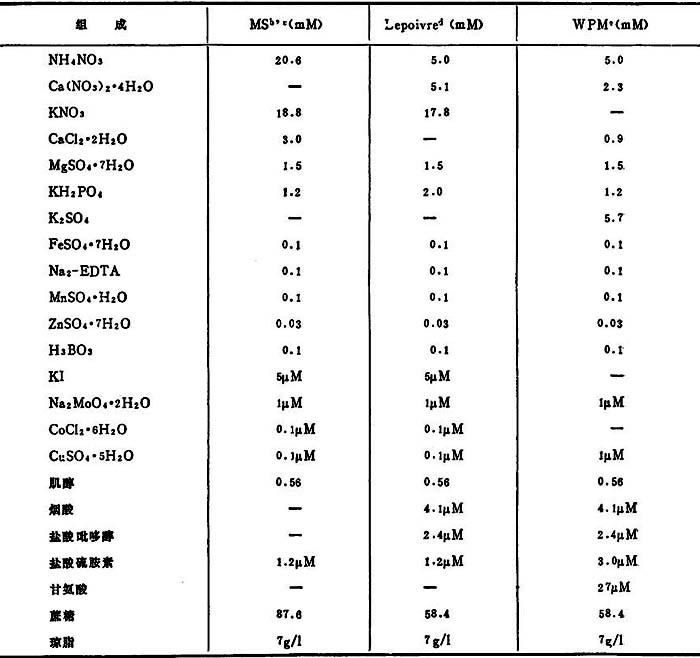
a.BA,IBA和GA3浓度见本文原生克隆。
b.Murashige与SKoog,1962。
c.1/2盐类和蔗糖用于生根。
d.Quoirin等,1977。
e.Lloyd与MeCown1980。
增殖率因栽培品种而异,但其正常范围四周内在3∶1-6∶1。增殖率低或芽无旺势,可只选取人工培养产生的芽尖培养更新,淘汰基部成丛的芽。有些情况下,可用除去芽上的叶,把芽倒插在琼脂中。
增殖培养物生长条件是24-26℃,16h光周期,光强50-70μEm-2s-1(400-700nm)40W暖白或冷白荧光灯。
芽增殖技术主要差异,Jones(1976)用改进MS+1mM PG,应用于几种不同苹果砧木和栽培品种。
Snir与Erez(1980)在固体MS培养上芽增殖,较长芽生根,较短的进一步增殖,培养在液体MS(不加PG),放在轨道振荡4天,16h光周期。液培生长率较快,移到固体培养基上芽增殖强烈。但每月繁殖5倍与其他用固体培养基的结果相似。
4.生根 将增殖培养物中的旺盛生长的芽,切成长约2-3cm小段。放在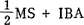 (浓度视栽培品种而定)不加BA或GA3。大多数栽培品种,0.5-1.5μM IBA生根最适,难生根的如Delicious以4.9μM较好。高于此抑制生长,促进愈伤组织生产,即使4.9μM IBA,也能对大多数栽培品种诱导形成相当多愈伤组织。切枝在4周内生根良好,可供移植。生根条件同增殖所述。
(浓度视栽培品种而定)不加BA或GA3。大多数栽培品种,0.5-1.5μM IBA生根最适,难生根的如Delicious以4.9μM较好。高于此抑制生长,促进愈伤组织生产,即使4.9μM IBA,也能对大多数栽培品种诱导形成相当多愈伤组织。切枝在4周内生根良好,可供移植。生根条件同增殖所述。
切枝液培用蛭石、真珠岩或沙支撑,0-0.05μM,甚至高到49.2μM IBA,都能生根。琼脂培养基上根系发育似乎较好。
有些学者为了克服茎基部过度产生愈伤组织和改进根伸长,将切枝从加生长素(IBA或NAA)培养基培养4天-4周后,转移到不加生长调节剂培养基上培养,培养基全部用MS:Lane(1978)用MS+10μM NAA;James与Thunbon(1979,1981)用MS加1mM PG和4.9-24.6μM IBA或28.5μM IAA;Snir与Erez(1980)用 IBA。4周后将切枝移至不加生长调节剂的同样培养基上,4-6天后转到
IBA。4周后将切枝移至不加生长调节剂的同样培养基上,4-6天后转到 不加生长调节剂,和6-8天后转到
不加生长调节剂,和6-8天后转到 不加生长调节剂加0.25%活性碳。可是,Sonathan切枝在
不加生长调节剂加0.25%活性碳。可是,Sonathan切枝在 加1.5μM IBA4周生根最好,与不加IBA培养4、8,或12天的相比。由此可知,最好的生长素浓度以供给最低需要以满足根的启动,由此这种浓度根系发育最大,较低促进愈伤组织生长。
加1.5μM IBA4周生根最好,与不加IBA培养4、8,或12天的相比。由此可知,最好的生长素浓度以供给最低需要以满足根的启动,由此这种浓度根系发育最大,较低促进愈伤组织生长。
砧木M.7在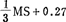 琼脂和4.9-14.7μMI BA生根。将长5-10mm切段漂在这种培养基上,4周内生根好。用
琼脂和4.9-14.7μMI BA生根。将长5-10mm切段漂在这种培养基上,4周内生根好。用 液基放在往复振荡器上70次/min,Gramy Smith80%生根。培养基含29.2mM蔗糖和10μM IBA。培养条件连续光照10-15μEm-2s-1,26℃。
液基放在往复振荡器上70次/min,Gramy Smith80%生根。培养基含29.2mM蔗糖和10μM IBA。培养条件连续光照10-15μEm-2s-1,26℃。
5.驯化 生根培养基上生长4-6周的生根切枝移出培养瓶,洗去根际琼脂,栽在土混合体中(泥炭-石混合∶蛭石∶真珠岩1∶1∶1)。特别注意此时要防止几分钟就会失水干萎。将钵放进可在叶面保持薄层水的雾罩系统中。不要过多浇水。每隔3-6min放雾1或2s。茎尖活跃生长后,就不再放雾。如果在转入雾罩前放在高光强125-150μEm-2s-1,高湿度(90-100%)下几周结果较好。如果带根切枝从琼脂吸取营养,根直接处于通气营养溶液,在这样较高光强和湿度下,芽和根生长很快。可是,产生的植株移栽困难,极易萎蔫。
初步试验提出在25mm直径试验管或指形管生根的切枝,在移出管外前,先去塞驯化5或6天。叶缘有些变干但植株不萎蔫。把植株移入土混合体后,可暴露在试验室大气条件下,芽继续不间断地生长。生长大容器(70-100mm直径)内的带根植株,在同样处理下,萎蔫很快,严重干枯。
Jones等(1979)报道了3周后,将小、根良好植株移出生根培养基,放在无菌试管滤纸桥上,加有同样成分的 盐类液体培养基,加58.4mM蔗糖,不加IBA或PG。试管放进温室,10天后,移栽堆杂肥中,潮湿繁殖箱,遮荫温室。14天后,可移至正常温室条件下生长。
盐类液体培养基,加58.4mM蔗糖,不加IBA或PG。试管放进温室,10天后,移栽堆杂肥中,潮湿繁殖箱,遮荫温室。14天后,可移至正常温室条件下生长。
(三)无病毒植株
常用热处理消除苹果病毒,但有少数病毒如苹果干槽无效。分生组织尖培养与指数技术结合用于消除病毒。另一方法,人工培养下将分生组织尖嫁接在15日龄幼苗上,人工培养下发芽,或在子叶上15mm(Alskieff与Villemur,1978)或子叶下方切段。前者成功率23%,后者65%。视年中时间而异,4-6月成功率最高。此法曾用于消除干槽病毒。
(四)种质保存
低温储藏苹果作为保存适合需要种质研究很少。休眠苹果芽在液氮中保持生存23个月。Golden Delicius单芽人工培养保存在1和4℃达一年,恢复到26℃(标准培养条件)增殖新芽。许多苹果栽培品种增殖培养物曾在2-4℃保存一年,当移至新鲜培养基上,放置标准生长条件生长良好,但必需经常转移。甚至有些栽培品种人工培养保存在2-4℃下生根,但人工培养的带根切枝放置低温,储藏效果不如增殖培养体。
(五)展望
苹果微繁殖虽已很快转变为商业技术,有些问题尚待解决。其一扩大应用于许多重要栽培品种如Delicious及其不同品系。其二可为商业接受的离体培养下带根切枝驯化有效技术,尚待研究。
体细胞胚胎发生繁殖是大规模繁殖的很有用技术。当然这有赖于体细胞胚产生遗传稳定植株。植株变异可用于遗传改良,筛选抗病、虫和其它优良特性的幼苗。
从愈伤组织、细胞或原生质体再生苹果植株的方法有待开发。再者诱变处理可应用于细胞、植株各部分或幼株诱变突变,并与人工培养筛选结合,为苹果育种家提供快速有力改良手段。
【参考文献】:
〔1〕Berg,L.A.and M.Bustamante 1974 Heat treatment and Meristem culture for the prodaction of virus free bananas.Phytopathology,64∶320——322.
〔2〕Cox, E。A.,G.Stotzkv and R.D.Goos 1960 In vitro culture of Musa Balbisiana Colla embryos.Nature 185∶403-404.
〔3〕de Guzman,E.V.,E.M.Ubalde and A.G.Del Rosario 1976 Banana and coconut in vitro cultures for induced mutation studies.In∶Improrement of Vegetativelv Propagatcdp lants and Tree Crops through Induced Mutations.pp.33-54.Iotern,Atomic Energy Agency,Technical Dacument,194,Vienna.
〔4〕Mohan Ram,H.Y.and F.C.Steward 1964 The induction of growth in explanted tissu e of banana fruit.Can.J.Bot.42∶1559-1579.
〔5〕Vakili,N.G。1967 The experimental formation of polyploidy and its effecton the genus Musa.Am.J。Bot,54∶24-36.
〔6〕Mehra,A。and P。N.Mehra 1974 Organogenesis and plantlet formation in vitro in almond,Bot.Gaz.135∶61-73.
〔7〕Rugini,E.and D。C,Verma 1983 Micropropagation of difficultto-propagate almond(Prunus amygdalus Batsch)cultivar.Plant Sci.Zetters.28∶273-281.
〔8〕Tabachnik,L.and D.E.Kester 1977 Shoot culture for almond and almond-peach hybrid clones in vitro.Hortscience 12∶545-547.
〔9〕Boxus,P.1978 The production of fruit and vegetable plants by in vitro cultureactual possibilities and perspectives.In∶National Technical Information Service(K.W.Hughes,R.Henke and M.Constantin,eds.)pp.44-58,U.S.Depa rtment of Energy,Springfield,Virginia.
〔10〕 Chenge,T.Y.1978 clonal propagation of woody plant speci es through tissue culture techniques.Proc.Int.plant Prop,Soc,28∶139-155.
〔11〕Marashige,T.1974 plant propagation through tissue culture.Am.Rev.plant physoil.25∶135-166.
〔12〕 Skirvin,R.M.1978 Natural and induced variation in tissue culture.Euphytica 27∶241-266.
〔13〕 Skirvin,R.M.1981(The tissue culture of)fruit crops.In∶cloning Agricultural plants via In vitro Techniques(B.V.Conger,ed.)pp.51-139 Chemical Rubber Company Press,Boca Raton,Florida.
〔14〕 Lane,W.D.1982 Tissue culture and in vitco propagation of deciduous fruit and nut species.In∶Application of Plant Cell and Tissue culture to Agriculture and Industry.(D.T.Tomes,B.E.Ellis,P.M.Harney,K.J.Kasha,and R.L.Peterson,eds.)pp.163-186.plant Cell Cullare Centre,Univ.of Guklph,Guelph,Ontario.
〔15〕 U.S.Department of Agriculture.1980 Proceednig on The Confer ence on Nars-ery Production of Fruit plants and Education Administration,Agricultural Research Results,ARR-NE-11,Beltsville,Maryland.
〔16〕Zimmerman,R.H.1983,Tissue culture.In∶Methods in Fruit Breeding(J.N.Moore and J.Janick,eds.)pp.124-135.Purdue Univ.Press West Lafayette,Indiana.