偏摩尔量
出处:按学科分类—数理科学和化学 东北大学出版社《无机物热力学数据手册》第8页(4367字)
1.偏摩尔量
溶液中组元Bi的热力学性质与纯组元有所不同。因此引入偏摩尔量

式中 Yi——组元Bi的偏摩尔量,它是温度、压力和浓度的函度。有的文献用 表示偏摩尔量;
表示偏摩尔量;
T——温度;
p——压力;
ni——组元Bi的物质的量;
nj——除Bi而外其他组元的物质的量;
Y——体系的容量性质。Y可以是体积、内能、焓、熵、亥姆霍茨自由能和吉布斯自由能。例如,偏摩尔焓为

偏摩尔熵为

体系的容量性质Y等于其中各组元的偏摩尔量与物质的量ni的乘积之和:

对1mol溶液,上式可写为

式中 Ym——溶液的摩尔热力学性质;
xi——组元Bi的摩尔分数。
式(45)和式(46)都称为偏摩尔量的集合公式。
2.相对偏摩尔量
对于Hi,Gi等,由于不知道其绝对值,通常采用相对偏摩尔量。在温度、压力和溶液浓度一定时,组元Bi的偏摩尔量与纯Bi的摩尔量之差,称为相对偏摩尔量,以△Yi表之。例如:
相对偏摩尔焓
△Hi=Hi-Hiθ (47)
相对偏摩尔熵
△Si=Si-Siθ (48)
式中Hiθ,Siθ分别是纯Bi的摩尔焓和摩尔熵。
△Hi相当于下列溶解过程的焓变
Bi=〔Bi〕
方括号内的Bi表示溶于溶液中的Bi。△Hi又称为偏摩尔溶解焓(热),单位为J·mol-1。类似地,△Si又称为偏摩尔溶解熵;△Gi又称为偏摩尔溶解自由能。
本书表3-1中列出了某些二元合金的相对偏摩尔量的数据。
3.混合热力学性质
溶液中各组元△Hi与xi的乘积之总和,称为该溶液的混合焓(热),以△Hm表之,即

有的文献称△Hi为微分混合热,把AHm称为积分混合热。
类似地亦有混合熵和混合自由能:

式(49)至(51)均为集合公式。某些二元合金的△Hm可在表3-1中查到。该表中省略了角标“m”。
4.化学势
偏摩尔吉布斯自由能又称化学势,符号为μi,

纯物质的化学势就等于该物质的摩尔吉布斯自由能。μi是温度、压力和浓度的函数(压力对凝聚相中μi的影响甚小)。
1)理想气体中组元Bi的化学势用下式表示:

式中 pi——组元Bi的分压,单位为Pa;
pθ——标准态的压力,pθ=101.325kPa;
R——(摩尔)气体常数;
μiθ(g)——标准化学势,即当pi=pθ时的化学势,它是温度的函数。
对实际气体(尤其是在高压低温下),用逸度f代替压力,组元Bi的化学势为

fi=γipi (55)
式中 fi——组元Bi的逸度,Pa;
yi——逸度系数,其值体现了实际气体对理想气体的偏差程度。
当温度较高,压力较低时,实际气体的行为接近理想气体。这时γi→1,fi→pi。
2)理想溶液中组元Bi的化学势理想溶液中溶质、溶剂在全部浓度范围内都遵守拉乌尔定律:

式中 pi——组元Bi的蒸气压;
pi*——纯Bi的蒸气压;
xi——Bi的摩尔分数。
溶液中组元Bi的化学势μi等于与之平衡的气相(设为理想气体)中Bi的化学势,故将式(56)代入
式(53)中,得

上式等号右边前两项与浓度无关,合并为μiθ,得
μi=μiθ+RTlnxi (58)
μiθ是Bi的标准化学势,即纯Bi(xi=1时)的化学势。它是温度和压力的函数,但实际上压力的影响很小,主要受温度影响。式(58)还可写为
△Gi=μi-μiθ=RTlnxi (59)
3)实际溶液中组元Bi的化学势 实际溶液不服从拉乌尔定律。为使式(58)和(59)保持其形式不变而又能适用于实际溶液,须将其中的浓度xi加以校正,即乘上一个系数γi,得
μi=μiθ+RTlnγixi=μiθ+RTlnai (60)
式中
ai=γixi (61)
ai称为组元Bi的活度;γi称为活度系数。γi>1表示Bi对拉乌尔定律(即对理想溶液)呈正偏差;γi<1为负偏差;γi=1则为理想溶液。式(60)中的标准化学势μiθ也就是纯Bi的化学势,ai是以纯物质Bi为标准态的活度(其它标准态参见下节)。
5.过剩函数
实际溶液中Bi的相对偏摩尔吉布斯自由能为
△Gi=μi-μiθ=RTlnai (62)
或
△Gi=RT1nγi+RT1nxi (63)
上式右边第二项是理想溶液的相对偏摩尔吉布斯自由能,以△Gi“表之;第一项RTlnγi乃是实际溶液的△Gi与理想溶液的△Gi“之差,称为Bi的偏摩尔过剩吉布斯自由能,以 表之(有的文献用
表之(有的文献用 表示):
表示):

 的绝对值体现了实际溶液对理想溶液的偏差程度;
的绝对值体现了实际溶液对理想溶液的偏差程度;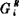 >0为正偏差;
>0为正偏差; <0为负偏差。
<0为负偏差。
1mol溶液的过剩吉布斯自由能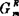 是各组元的
是各组元的 与其摩尔分数乘积之总和:
与其摩尔分数乘积之总和:

根据热力学关系式 ,=-S,将式(59)对T求偏导,可得理想溶液中Bi的相对偏摩尔熵为
,=-S,将式(59)对T求偏导,可得理想溶液中Bi的相对偏摩尔熵为

实际溶液中Bi的相对偏摩尔熵△Si与同浓度的理想溶液中的相对偏摩尔熵 之差,称为Bi的过剩熵,以
之差,称为Bi的过剩熵,以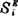 表之:
表之:

形成1mol溶液的混合熵为

因为由纯组元混合成理想溶液的过程没有热效应,即 =0,
=0,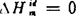 ,所以,实际溶液的△Hi和△Hm分别等于
,所以,实际溶液的△Hi和△Hm分别等于 和
和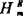 ,即
,即

本书表3-1中列出了某些二元合金的 ,
, ,
,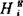 ,
, ,
, 和
和 (表中已略去角标m)。只要查出其中两组数据,另一组即可算出。
(表中已略去角标m)。只要查出其中两组数据,另一组即可算出。
〔计算实例〕 由表3-1-11中查得1400K的Cu-Sn合金在xsn=0.3时, ,
, =-3908J·mol-1;又由表3-1-12中查得
=-3908J·mol-1;又由表3-1-12中查得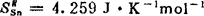 ,
, 。则可算出其它的热力学函数如下:
。则可算出其它的热力学函数如下:

〔计算实例〕 已知1873K的铁液中含钒为0.08%,求反应2〔V〕+3/2O2=V2O3(s)的Kθ和平衡氧分压。若po2=101.3kPa,求反应的AG。
首先,由表2-3查得下列反应的AGθ
2V(s)+3/2O2=V2O3(s) △Gθ=-1202900+237.53T,J·mol-1
在T=1873K时,△Gθ=-758kJ·mol-1。若〔V〕的标准态为纯固体钒,则-758kJ·mol-1即为所求反应的△Gθ,所以
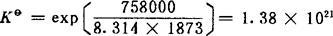
其次再由表3-2查得1873K的铁液中含钒无限稀时的活度系数 的定义见式(77)〕。由于铁液含钒很低,可以认为
的定义见式(77)〕。由于铁液含钒很低,可以认为 。钒和铁的摩尔质量分别是50.94和55.85g·mol-1,所以
。钒和铁的摩尔质量分别是50.94和55.85g·mol-1,所以

av=γvxv=0.1×8.77×10-4=8.77×10-5

将Kθ=1.38×1021代入上式,求得po2/pθ=2.07×10-9
∴ po3=2.07×10-9×101325=2.10×10-4Pa
当po2=101.3kPa时,
