熵和自由能
出处:按学科分类—数理科学和化学 东北大学出版社《无机物热力学数据手册》第3页(1594字)
热力学利用熵(S)和自由能(G或F)状态函数来判断过程自发进行的方向和平衡状态。过程熵变的基本公式是

式中角注R表示可逆过程。由热力学第二定律的原理可以推出,对孤立体系,
dS≥0 (17)
“>”适用于自发过程,“=”适用于可逆过程,在这里也就是平衡状态。
由于用熵变来判断过程的自发性要在孤立系的条件下进行,这对化学反应和相变来说不太方便,所以热力学又引入了吉布斯自由能G和亥姆霍茨自由能F两个状态函数。它们的定义是:
G=H-TS (18)
F=U-TS (19)
判断自发和平衡的公式为:
恒温恒压下,
dG≤0 (20)
恒温恒容下,
dF≤0 (21)
“<”为自发,“=”为平衡条件。
对化学反应来说,这两个函数中,以G的应用较广,本书只讨论G的计算。G也称为吉布斯函数或自由焓,单位为J或kJ。
1.熵的计算
由热力学第三定律可知,在绝对零度(0K)时,任何纯物质完整晶体的熵都等于零,即
S0=0 (22)
在恒压下,以δQ=C,dT代入式(16),并应用于标准状态下1mol的纯物质Bi,可得绝对熵(标准摩尔熵)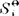 与温度的关系式为:
与温度的关系式为:

在低温下,特别是接近绝对零度时,C,与T的关系不能用式(8)的经验式表示。通常是根据统计热力学公式,利用物质光谱数据计算出来。式中最后一项是0→298K的温度范围内所有相变过程熵变之和。本书表2-1已将由资料查出的Siθ(298)列于表上,以298K时的S表示。298K温度以上的Siθ(T)用下式计算:
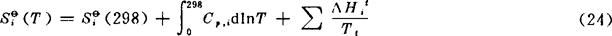
Cp,i可用式(8)代入积分,在温度间隔内有相变时,要加入式(24)最后一项的相变熵,本书每隔200K计算一个S值列于表上,当温度间隔内有相变时,其相变温度及相变熵值均已列于表上。S的单位为J·K-1·mol-1。
2.自由能的计算
本书所列物质Bi的自由能Gi,kJ·mol-1,其计算公式与式(18)一致,即
Gi=Hi-TSi (25)
由于Hi是按式(9)算出的相对值,所以Gi也是相对值。计算时单位要取得一致,Si要将J换成kJ。表2-1已列出各相应温度的Gi值。
对于一个化学反应,如式(12),其标准自由能变化的计算公式为:

在这里,由于Hi以单质为零而引进的相对性,在式(26)中右边加和时已经抵销,所以不影响反应△Gθ的计算。
表2-1所列化合物的Gi,与此化合物的标准生成自由能AfGiθ不同,它们的关系是:

式中∑vjGj为生成此化合物的单质Gj的代数和。
化学反应的标准自由能变化△Gθ除可按公式(26),利用表2-1的数据计算外,还可以利用表2-3△fGiθ与温度的关系式△Gθ=A+BT来计算。对反应(12),

用式(26)和式(28)计算△Gθ有时有些差别,这仅仅是由于两者所用的经验常数不同,近似程度不同所引起的。