(5)香蕉和土壤中残留量检测方法
出处:按学科分类—农业科学 中国农业出版社《农药残留量实用检测方法手册第3卷》第332页(3281字)
广东省农业科学院植物保护研究所 孙海滨
样本中代森锰锌在加热条件下酸解成CS2,气相色谱法(FPD)测定CS2含量,然后换算为代森锰锌残留量。样本中主要代谢产物乙撑硫脲(ETU),用甲醇提取,正己烷液-液分配,氧化铝柱层析净化,液相色谱法(UV)测定。
1.主要仪器及设备
气相色谱仪 火焰光度检测器(FPD-S)
高效液相色谱仪 紫外二极管阵列检测器(DAD)
旋转蒸发器
国际型振荡器
反应瓶 25mL顶空进样瓶,配聚四氟乙烯盖
超级恒温水浴(±1℃)
高速组织捣碎机
2.主要试剂
甲醇(光谱纯)、甲醇、丙酮、正己烷、三氯甲烷、氨水、离子水、1%和25%甘油乙醇溶液、盐酸、10%乙二胺四乙酸二钠盐(EDTA)溶液、氯化亚锡、氢氧化钠、氯化钠、无水硫酸钠
淋洗液 乙醇/三氯甲烷混合液(4∶96,V/V)
中性氧化铝 60~80目
二硫化碳(CS2)标准品、代森锰锌标准品
代森锰锌标准悬浮液 称取代森锰锌标准品放入250mL烧杯中,准确加入100mL水磁力搅拌10min,定容,此标准悬浮液现用现配。
ETU标准品
3.检测步骤
3.1 代森锰锌的检测
3.1.1 称样与酸解
称取2.0g(净重)匀浆香蕉样本或土壤样本于反应瓶中,加入2mL10%乙二胺四乙酸二钠盐(EDTA)溶液和4mL3%氯化亚锡溶液并加入2mL水,将反应瓶转移至80℃水浴中反应2h,在反应过程中,每隔0.5h时取出反应瓶振荡1min。反应完毕后,将反应瓶转入40±1℃恒温水浴中,待气液平衡后,用气密进样针吸反应瓶上部空间气体40L,进行气相色谱分析。
3.1.2 气相色谱法测定
检测器 FPD-S
色谱柱 HP-35,15m×0.53mm石英交联毛细管柱
温度 柱温50~60℃;进样口120℃;检测器160℃
载气 高纯氮,50mL/min
燃烧气 空气60mL/min,氢气50mL/min
柱前压 2psi
进样量 40L
保留时间 1.9min
3.2 ETU的检测
3.2.1 提取
称取50.0g(净重)匀浆香蕉样本放入250mL具塞三角瓶中,加入70mL75%甲醇水溶液和15g氯化钠,振荡提取1h,用布氏漏斗过滤。滤渣用50mL75%甲醇水溶液,振荡0.5h,过滤,用甲醇多次冲洗三角瓶和布氏漏斗,合并滤液。
3.2.2 净化
3.2.2.1 液-液分配
滤液用50mL×3正己烷洗涤,弃去正己烷相。水相用甲醇定容至200mL,分取50mL于100mL蒸发瓶中,加入2滴1%甘油乙醇溶液,用旋转蒸发器(60℃)减压浓缩至约5mL,加入1mL1%氨水,静置0.5h。向蒸发瓶中加入50mL淋洗液,边搅拌边加入无水硫酸钠,至吸去水分。
3.2.2.2 柱层析净化
将上述脱水溶液过装有5g氧化铝层析柱,用200mL淋洗液洗脱。收集洗脱液,加入10mL水和6滴25 %甘油乙醇溶液,用旋转蒸发器(60℃)减压浓缩至3mL,用流动相溶液定容5mL后,供测定。
3.2.2.3 液相色谱法测定
检测器 DAD
波长 240nm
色谱柱 HypersilODS C18,250mm×4mm×5μm
流动相 甲醇/水(5∶95,V/V)
温度 室温
流速 0.6mL/min
进样量 20~40μL
保留时间 5.6min
4.结果计算
外标(峰面积)-标准曲线法定量
代森锰锌的CS2释放量,实测为57%
5.灵敏度、准确度和精确度
最小检出量 1×10-10g(CS2)、5×10-10g(ETU)。
最低检测浓度 0.01mg/kg(CS2)、0.005mg/kg(ETU)。
代森锰锌回收率 香蕉全果、果肉及土壤中添加代森锰锌0.05~1.00mg/kg时,平均回收率为82.3%~87.2%,见表2-20-11。
相对标准偏差 1.7%~8.0%,见表2-20-11。
ETU回收率 香蕉全果、果肉及土壤中添加ETU0.05~1.00mg/kg时,平均回收率为81.8%~86.7%,见表2-20-11。
相对标准偏差 2.4%~6.6%,见表2-20-11。
表2-20-11 香蕉和土壤中代森锰锌及ETU添加回收率及相对标准偏差实验结果

6.香蕉和土壤中代森锰锌(CS2)及ETU测定谱图
见图2-20-7。
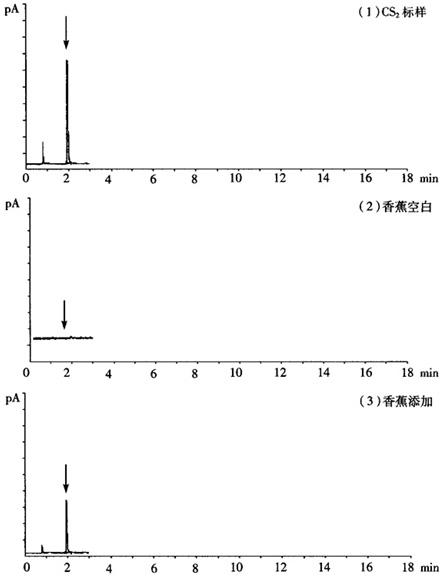


图2-20-7 香蕉和土壤中代森锰锌(CS2)及ETU测定谱图