(1)大豆和土壤中残留量检测方法
出处:按学科分类—农业科学 中国农业出版社《农药残留量实用检测方法手册第3卷》第536页(2760字)
中国农业科学院植物保护研究所 郑永权 董丰收 姚建仁
样本用丙酮或甲醇提取,石油醚液-液分配,弗罗里硅土和中性氧化铝柱层析净化,气相色谱法(ECI))测定。
1.主要仪器及设备
气相色谱仪 电子捕获检测器(ECD)
回旋式振荡器
超声波清洗器
高速分散机
真空旋转蒸发器
层析柱 (A)10mm×200mm,(B)15mm×300mm
2.主要试剂
石油醚(60~90℃,重蒸)、丙酮(重蒸)、甲醇(重蒸)、乙酸乙酯(重蒸)、无水硫酸钠、弗罗里硅土
中性氧化铝 130℃烘烤4h
活性炭 颗粒剂,酸洗
异丙草胺标准品
3.检测步骤
3.1 提取
3.1.1 土壤
称取50g样本于具塞三角瓶中,加5mL1%氯化铵水溶液,拌匀。再加入70mL甲醇静置过夜,振荡提取2h,抽滤。滤渣再用30mL甲醇洗涤3次,合并滤液。
3.1.2 豆粉
称取20g粉碎的豆粉于具塞三角瓶中,加70mL丙酮/水(4∶1,V/V),静置过夜,振荡提取2h,抽滤。滤渣用30mL丙酮/水(4∶1,V/V)洗涤,合并滤液。
3.1.3 青豆
称取20g青豆于高速组织捣碎机中,加入50mL丙酮/水(4∶1,V/V),匀浆2min,抽滤。滤渣用50mL丙酮/水(4∶1,V/V)洗涤,合并滤液。
3.1.4 大豆植株
称取10g粉碎样本于具塞三角瓶中,加70mL丙酮/水(4∶1,V/V)静置过夜,振荡提取2h,抽滤。滤渣用30mL提取剂洗涤,合并滤液。
3.2 净化
3.2.1 液-液分配
将合并后的滤液转入500mL分液漏斗中,加入200mL2%硫酸钠溶液和100mL、50mL石油醚,剧烈振荡萃取两次。分出石油醚相,用10mL石油醚洗涤分液漏斗。合并石油醚相,经过无水硫酸钠脱水后收集于平底烧瓶中,用旋转蒸发器浓缩(40℃)至2mL。
3.2.2 柱层析净化
3.2.2.1 青豆和土壤
在A层析柱内,依次加入2cm无水硫酸钠、10g中性氧化铝和4cm无水硫酸钠,用10mL石油醚预淋。将青豆(土壤)的浓缩液转入柱内,用20mL石油醚/乙酸乙酯(95∶5,V/V)淋洗,弃去。用70mL石油醚/乙酸乙酯(2∶1,V/V)洗脱并收集,用旋转蒸发器(40℃)浓缩至1mL,定容至5mL,待测。
3.2.2.2 豆粉和植株
在B层析柱内,依次加入2cm无水硫酸钠、15g弗罗里硅土、1g活性炭和4cm无水硫酸钠,用10mL石油醚预淋。将大豆(植株)的浓缩液转入柱内,用20mL石油醚/乙酸乙酯(95∶5,V/V)淋洗,弃去。用70mL石油醚/乙酸乙酯(2∶1,V/V)洗脱并收集,用旋转蒸发器(40℃)浓缩至1mL,定容至5mL,待测。
3.3 气相色谱法测定
检测器 ECD
色谱柱 2mmi.d.×2m玻璃柱,3%SE-30/Chromosorb W(AW-DMCS),80~100目
检测温度 柱温170℃;进样口250℃;检测器300℃
载气 高纯氮,30mL/min
进样量 1μL
保留时间 8.55min
4.结果计算
外标(峰高)-标准曲线法定量
5.灵敏度、准确度和精确度
最小检出量 1×10-11g。
最低检测浓度 青豆、黄豆0.0025mg/kg,植株0.005mg/kg,土壤0.001mg/kg。
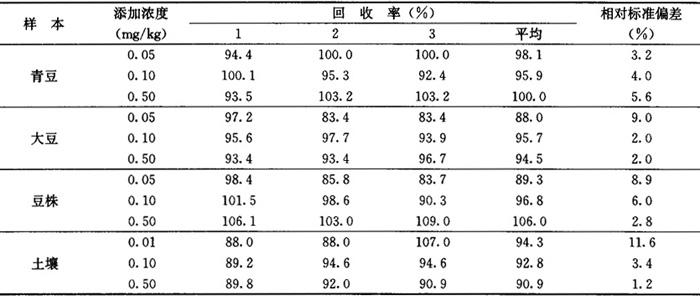
回收率 土壤、青豆、大豆及植株中添加异丙草胺0.01~0.50mg/kg时,平均回收率分别为90.9%~94.3%、95.9%~100.0%、88.0%~95.7%和89.3%~106.0%。见表3-30-1。
相对标准偏差 1.2%~11.6%,见表3-30-1。
表3-30-1 土壤、青豆、豆粉和植株中异丙草胺添加回收率及相对标准偏差实验结果
6.大豆和土壤中异丙草胺气相色谱测定谱图
见图3-30-1。

图3-30-1 大豆和土壤中异丙草胺气相色谱测定谱图