溶液的pH及有关计算
书籍:高中数理化公式定理大全
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《高中数理化公式定理大全》第400页(916字)
1.基本关系式:
①)pH=—lg{c(H+)}
②c(H+)=10—pHmol/L
③在任何水溶液中,由水电离产生的c(H+)与c(OH—)总是相等的:c水(H+)=c水(OH—)
④常温(25℃)时:Kω=c(H+)·c(OH—)=1×10—14
2.强酸与弱酸、强碱与弱碱溶液加水稀释后pH的计算:
a.强酸与弱酸加水均稀释10n倍时:
强酸:pH稀=pH原+n
弱酸:pH稀
b.强碱与弱碱溶液加水均稀释10n时:
强碱:pH稀=pH原—n
弱碱:pH稀>pH原—n
注 酸溶液无论如何稀释,溶液的pH都不会大于7;碱溶液无论如何稀释,溶液的pH都不会小于7.当它们无限稀释时,溶液的pH只能无限接近于7,因此时需考虑水的电离.
3.混合溶液的pH计算
①两强酸混合
先求:
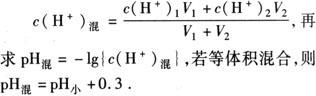
②两强碱混合:

③强酸与强碱混合:
a.若恰好中和,混合液显中性,pH=7.
