前线轨道理论
出处:按学科分类—自然科学总论 天津人民出版社《自然辩证法辞典》第643页(1445字)
分子轨道理论的一种,是50年代初由福井谦一发展起来的。
前线轨道理论指出,分子的许多性质主要是由分子中的前线轨道,即最高占据分子轨道(HOM())和最低空的分子轨道(LUMO)所决定的。这个理论的依据是容易理解的:在分子中,HOMO轨道上的电子能量最高,所受束缚最小,所以最活泼,容易变动,而LUMO轨道在所有的空轨道中能量最低,最容易接受电子,因此这两个轨道决定着分子的电子得失和转移能力,决定着分子间反应的空间取向等等重要化学性质。
在有机化学中,特别对芳香族化合物,确定各个原子位置在亲电或亲核取代反应的相对活性是一个重要的问题。
已经提出了各种理论指标,如电荷密度分布,定域能方法等。
前线轨道理论认为,最高占据分子轨道HOMO上的电子在各个原子上有一定的电荷密度分布,这个分布的大小次序决定亲电试剂进攻各个原子位置的相对易难程度,即亲电反应最易发生在HOMO最大电荷密度的原子上;类似地,亲核反应在各个原子上发生的相对次序由LUMO的电荷密度分布所决定,核试剂最易进攻LUMO电荷密最大的原子。一般说来,各种理论指标预言的活性次序大致是相同的,但也有一些例外,比如萤蒽(C16H10)的硝化亲电反应,各种理论预言的反应活性指标及实验结果总结如下表:
表2 反应活性指标及实验结果
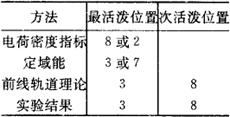
上述结果表明,对这个例子,前线轨道理论的结果与实验一致。
对于两个分子A和B间的反应,前线轨道理论给出的图象为:
SLUMO LUMOa
aHOMO HOMOS
A分子 B分子
a 反对称符号
s 对称符号
HOMO能级低于LUMO,需外界提供能量实现电子由HOMO流向LUMO
图13 相同分子反应图
aLUMO LUMOS
SHOMO HOMOa
A分子 B分子
A、B不同时,当A分子的HOMO能级与B分子的LUMO能级相近,对称性相同时,电子从A中HOMO流向B中LUMO
图14 相异分子反应图
即分子A和B的HOMO中的电子分别流向对方的空轨道LUMO,从而引起化学键的生成和断裂,发生化学反应。只有分子A(或B)的HOMO与分子B(或A)的LUMO的能量比较接近,对称性也互相匹配时,才容易发生电子流动,上图为分子A和B相同时的情形,下图代表A和B不相同以A的HOMO中的电子流向B的LUMO为主的情形。着名的分子轨道对称守恒原理也可借助于前线轨道理论加以阐明。
必须指出,前线轨道理论不仅适用于π轨道,而且适用于σ轨道,因此它在有机化学、无机化学、以及表面吸咐与催化、量子生物学等领域都得到了应用。主要由于这方面的成就,福井谦一于1981年获得了诺贝尔奖金。