橙、柑、橘汁及其饮料中果汁含量的测定(摘自GB/T16771)
出处:按学科分类—工业技术 中国轻工业出版社《软饮料工业手册》第971页(16837字)
(一)范围
本标准规定了橙、柑、橘汁及其饮料中钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮6种组分的测定方法和用6种组分的实测值计算(推导)果汁含量的方法。
本标准适用于判定橙、柑、橘浓缩汁和果汁,以及果汁含量不低于2.5%的橙、柑、橘汁饮料。
(二)定义
1.浓缩汁、果汁及其饮料
定义同GB10789。
2.标准值
根据不同品种、不同产区、不同采收期、不同加工工艺、不同贮存期橙、柑、橘果汁及由其浓缩汁复原的果汁中可溶性固形物含量和6种组分实测值的分布状态,经数理统计确定的合理数值。
3.权值
根据6种组分实测值变异系数的大小而确定的某种组分在总体中所占的比例。
(三)方法提要
(1)按本标准规定的方法测定样品中6种组分。
(2)将6种组分的实测值分别与各自标准值的比值合理修正后,乘以相应的修正权值,逐项相加求得样品中的果汁含量。
(四)橙、柑、橘汁及其混合果汁的标准值和权值
1.可溶性固形物的标准值
20℃时,用折光计测定(不校正酸度),橙、柑、橘汁及其混合果汁可溶性固形物(加糖除外)的标准值,以不低于10.0%计。
2.6种组分的标准值和权值
6种组分的标准值和权值见表5-3-1。
表5-3-1
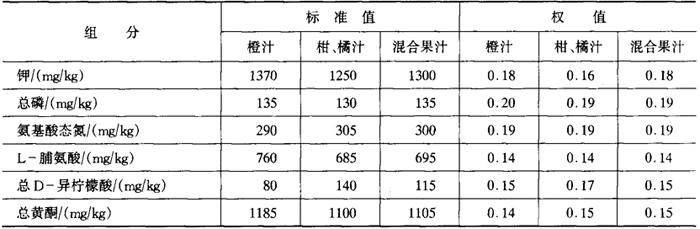
注:如标签上未标明橙汁或柑、橘汁时,以混合果汁计算。
(五)测定方法
1.可溶性固形物
按GB/T12143.1规定的方法测定。
2.钾
按附录A(标准的附录)测定。
3.总磷
按附录B(标准的附录)测定。
4.氨基酸态氮
按GB/T12143.2规定的方法测定。测定结果的单位以mg/kg表述。
5.L-脯氨酸
按附录C(标准的附录)测定。
6.总D-异柠檬酸
按附录D(标准的附录)测定。
7.总黄酮
按附录E(标准的附录)测定。
(六)果汁含量计算公式
橙、柑、橘汁及其饮料中果汁含量按式(1)计算:

式中 y——果汁含量,%
xi(1~6)——样品中相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮含量的实测值,mg/kg
Xi(1~6)——相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮的标准值,mg/kg
Ri(1~6)——相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮的权值。
(七)异常数据的修正原则
1.当 时(i=1、2、3、4、6),须将大于1.25的组分项删除,其权值按比例分配给剩余组分项;修正后的果汁含量按式(2)计算:
时(i=1、2、3、4、6),须将大于1.25的组分项删除,其权值按比例分配给剩余组分项;修正后的果汁含量按式(2)计算:

式中 y′——修正后的果汁含量,%
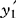 ——删除异常数据后果汁含量的计算值,%
——删除异常数据后果汁含量的计算值,%
Ri——被删除组分项的权值
2.当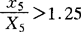 时,按1.25计算。
时,按1.25计算。
3.当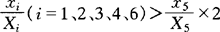 ;或
;或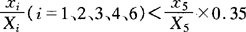 时,须将其组分项删除,相应的权值按比例分配给剩余组分项,按式(2)计算果汁含量。
时,须将其组分项删除,相应的权值按比例分配给剩余组分项,按式(2)计算果汁含量。
4.当同时修正3种组分时(总D-异柠檬酸除外),果汁含量按式(3)计算:

式中 y″——用总D-异柠檬酸组分项计算出的果汁含量,%
附录A(标准的附录)钾的测定
A1 方法提要
钾的基态原子吸收钾空心阴极灯发射的共振线,吸收强度与钾的浓度成正比。将处理过的样品吸入原子吸收分光光度计的火焰原子化系统中,使钾离子原子化,在共振线766.5nm处测定吸光度,与标准系列溶液比较,确定样品中钾的含量。添加适量钠盐,消除电离干扰。
A2 试剂
本试验方法中,所用试剂均为分析纯;实验用水应符合GB6682中三级水规格。
A2.1 硝酸(GB626)。
A2.2 硫酸(GB625)。
A2.3 10g/L氯化钠溶液:称取1.0g氯化钠(GB1266),用水溶解后定容至100mL。
A2.4 10%(体积分数)硝酸溶液:量取1体积硝酸(A2.1),注入9体积水中。
A2.5 50%(体积分数)盐酸溶液:量取1体积盐酸(GB622),注入1体积水中。
A2.6 钾标准溶液:称取0.9534g经150±3℃烘烤2h的氯化钾(GB646),精确至0.0001g。置于50mL烧杯中。加水溶解,转移到500mL容量瓶中。加2mL盐酸溶液(A2.5),用水定容至刻度,摇匀。吸取10.00mL于100mL容量瓶中,用水定容至刻度,摇匀。此溶液钾的含量为100mg/L。
A3 仪器与设备
实验室常规仪器、设备:
A3.1 原子吸收分光光度计:带钾空心阴极灯。
A3.2 空气压缩机或空气钢瓶气。
A3.3 乙炔钢瓶气。
A3.4 凯氏烧杯:500mL。
A3.5 天平:感量10mg。
A3.6 分析天平:感量0.1mg。
A4 试液的制备
称取一定量经混合均匀的样品(浓缩果汁1.00~2.00g;果汁5.00~10.00g;果汁饮料20.0~50.0g;水果饮料和果汁型碳酸饮料50.0~100.0g)于500mL凯氏烧瓶中,加入2~3粒玻璃珠、10~15mL硝酸(A2.1)、5mL硫酸(A2.2)(称样量大于20g的样品,须预先加热除去部分水分,待瓶中样液剩余约20g时停止加热,冷却,再加硝酸、硫酸),浸泡约2h或静置过夜。先用微火加热,待剧烈反应停止后,加大火力。溶液开始变为棕色时,立即滴加硝酸(A2.1),直至溶液透明,颜色不再变深为止。继续加热数分钟至浓白烟逸出,冷却,小心加入20mL水,再加热至白烟逸出,冷却至室温。将溶液转移到50mL容量瓶中,用水定容至刻度,摇匀,备用。
取相同量的硝酸、硫酸,按上述步骤做试剂空白消化液,备用。
A5 分析步骤
A5.1 工作曲线的绘制
吸取0.00,1.00,2.00,4.00,6.00,8.00,10.00mL钾标准溶液(A2.6),分别置于50mL容量瓶中,加10mL硝酸溶液(A2.4)、2.0mL氯化钠溶液(A2.3),用水定容至刻度,摇匀,配制成0.0,2.0,4.0,8.0,12.0,16.0,20.0mg/L钾标准系列溶液。
依次将上述标准系列溶液吸入原子化系统中,用0.0mg/L钾标准溶液调整零点,于波长766.5mn处测定钾标准系列溶液的吸光度。以吸光度为纵坐标,钾标准系列溶液的浓度为横坐标,绘制工作曲线或计算回归方程。
A5.2 测定
吸取5.0~20.0mL试液(A4)于50mL容量瓶中,加10mL硝酸溶液(A2.4)、2.0mL氯化钠溶液(A2.3),用水定容至刻度,摇匀。将此溶液吸入原子化系统中,用试剂空白溶液(A5.1)调整零点,于波长766.5nm处测吸光度,在工作曲线上查出(或用回归方程计算出)试液中钾的含量(c1)。
按上述步骤同时测定试剂空白消化液(A4.1)中钾的含量(c01)。
A6 分析结果的表述
样品中钾的含量按式(4)计算
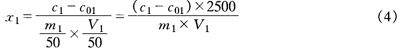
式中 x1——样品中钾的含量,mg/kg
c1——从工作曲线上查出(或用回归方程计算出)试液中钾的含量,mg/L
c01——从工作曲线上查出(或用回归方程计算出)试剂空白消化液中钾的含量,mg/L
V1——测定时吸取试液的体积,mL
m1——样品的质量,g
计算结果精确至小数点后第一位。
A7 允许差
同一样品的两次测定结果之差,不得超过平均值的5.0%。
附录B(标准的附录)总磷的测定
B1 方法提要
样品经消化后,在酸性条件下,磷酸盐与钒-钼酸铵反应呈现黄色,在波长400nm处测定溶液的吸光度,与标准系列溶液比较,确定样品中总磷的含量。
B2 试剂
本试验方法中,除特殊注明外,所用试剂均为分析纯;实验用水应符合GB6682中三级水规格。
B2.1 硝酸(GB626)。
B2.2 硫酸(GB625)。
B2.3 10%(体积分数)硫酸溶液:量取1体积硫酸(B2.2),缓慢注入9体积水中。
B2.4 钒-钼酸铵溶液:称取20.0g钼酸铵(GB657),溶解在约400mL50℃热水中,冷却。称取1.0g偏钒酸铵(HG3-941),溶解在300mL50℃热水中,冷却,边搅拌,边加入1mL硫酸(B2.2)。将钼酸铵溶液缓慢加到偏钒酸铵溶液中,搅拌均匀后转移到1000mL容量瓶中,用水定容至刻度。
B2.5 磷标准溶液:称取0.4394g经105±2℃烘烤2h的磷酸二氢钾(GB1274,优级纯),精确至0.0001g。置于50mL烧杯中。加水溶解,转移到1000mL容量瓶中,用水定容至刻度,摇匀。此溶液磷的含量为100mg/L。
B3 仪器
实验室常规仪器、设备:
B3.1 紫外分光光度计。
B3.2 凯氏烧瓶:500mL。
B3.3 天平:感量10mg。
B3.4 分析天平:感量0.1mg。
B4 试液的制备
按本标准附录A中A4步骤操作。
B5 分析步骤
B5.1 工作曲线的绘制
吸取0.00,1.00,2.00,3.00,4.00,5.00mL磷标准溶液(B2.5),分别置于50mL容量瓶中,加10mL硫酸溶液(B2.3),摇匀,加10mL钒-钼酸铵溶液(B2.4),用水定容至刻度,摇匀,配制成0.0,2.0,4.0,6.0,8.0,10.0mg/L磷标准系列溶液。在室温下放置10min。用1cm比色皿,以0.0mg/L磷标准溶液调整零点,在波长400nm处测定磷标准系列溶液的吸光度。以吸光度为纵坐标,磷的含量为横坐标,绘制工作曲线或计算回归方程。
B5.2 测定
吸取5.0~10.0mL试液(B4)于50mL容量瓶中,加硫酸溶液(B2.3)补足至10mL,以下步骤按B5.1操作。以试剂空白溶液调整零点,在波长400nm处测定吸光度。从工作曲线上查出(或用回归方程计算出)试液中磷的含量(c2),同时测定试剂空白消化液(A4)中磷的含量(c02)。
B6 分析结果的表述
样品中总磷的含量按式(5)计算:

式中 x2——样品中总磷的含量,mg/kg
c2——从工作曲线上查出(或用回归方程计算出)试液中磷的含量,mg/L
c02——从工作曲线上查出(或用回归方程计算出)试剂空白消化液中磷的含量,mg/L
V2——测定时吸取试液的体积,mL
m2——样品的质量,g
计算结果精确至小数点后第一位。
B7 允许差
同一样品的两次测定结果之差,不得超过平均值的5.0%。
附录C(标准的附录)L-脯氨酸的测定
C1 方法提要
L-脯氨酸与水合茚三酮作用,生成黄红色络合物。用乙酸丁酯萃取后的络合物,在波长509nm处测定吸光度,与标准系列溶液比较,确定样品中L-脯氨酸的含量。
C2 试剂
本试验方法中,所用试剂均为分析纯;实验用水应符合GB6682中三级水规格。
C2.1 乙酸丁酯(HG3-1466)。
C2.2 甲酸(HG3-1296)。
C2.3 无过氧化物乙二醇独甲醚的制备:将数粒锌粒放入乙二醇独甲醚(HG10-1105)中,在避光暗处放置2d。
C2.4 3.0%茚三酮乙二醇独甲醚溶液:称取3.0g水合茚三酮(进口分装或HG3-984),溶解在100mL无过氧化物的乙二醇独甲醚溶液(C2.3)中,贮存在棕色瓶内,置避光处。此溶液易被氧化,应每周制备一次。
C2.5 L-脯氨酸标准贮备溶液:称取0.0500gL-脯氨酸(生化试剂,C5H9NO2,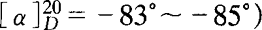 ,精确至0.0001g,置于50mL烧杯中,加水溶解,转移到100mL棕色容量瓶中,用水定容至刻度,摇匀,贮存在约4℃冰箱内。此溶液含L-脯氨酸为500mg/L。
,精确至0.0001g,置于50mL烧杯中,加水溶解,转移到100mL棕色容量瓶中,用水定容至刻度,摇匀,贮存在约4℃冰箱内。此溶液含L-脯氨酸为500mg/L。
C3 仪器
实验室常规仪器、设备如下列各项。
C3.1 分光光度计。
C3.2 具塞试管:25mL。
C3.3 离心机:转速不低于4000r/min,带10mL具塞离心管。
C3.4 分析天平:感量0.1mg。
C3.5 天平:感量10mg。
C4 试液的制备
称取一定量混合均匀的样品(浓缩汁1.00g;果汁5.00g;果汁饮料、水果饮料和果汁型碳酸饮料10.00~200.0g)于200mL容量瓶中,用水定容至刻度,摇匀,备用。
C5 分析步骤
C5.1 工作曲线的绘制
C5.1.1 显色
吸取0.00,0.50,1.00,2.50,4.00,5.00mL L-脯氨酸贮备溶液(C2.5)于50mL容量瓶中,用水定容至刻度,摇匀,配制成0.0,5.0,10.0,25.0,40.0,50.0mg/L的L-脯氨酸标准系列溶液。
吸取上述标准系列溶液各1.0mL,分别置于6支25mL具塞试管(C3.2)中,各加1mL甲酸(C2.2),充分摇匀,加2mL茚三酮乙二醇独甲醚溶液(C2.4),摇匀。将6支试管同时置于1000mL烧杯的沸水浴中(电炉与烧杯间需垫石棉网,水浴液面须高于试管液面)。待烧杯中的水沸腾后,精确计时15min,同时取出6支试管,置于20~22℃水浴中冷却10min。
C5.1.2 萃取、测定吸光度
在上述6支试管中各加10.0mL乙酸丁酯(C2.1),盖塞,充分摇匀,使黄红色络合物萃取到乙酸丁酯液层中。静置数分钟,将试管中的乙酸丁酯溶液分别倒入10mL具塞离心管中,盖塞。以2500r/min转速,离心5min。
将上层清液小心倒入1cm比色皿中,以试剂空白溶液调整零点,在波长509nm处测定各上层清液的吸光度。以吸光度为纵坐标,L-脯氨酸的浓度为横坐标,绘制工作曲线或计算回归方程。
C5.2 试液的测定
吸取1.0mL试剂(C4)于25mL具塞试管(C3.2)中,以下步骤按C5.1操作。从工作曲线上查出(或用回归方程计算出)试液中L-脯氨酸的含量(c4)。
C6 分析结果表述
样品中L-脯氨酸的含量按式(6)计算:
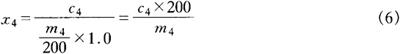
式中 x4——样品中L-脯氨酸的含量,mg/kg
c4——从工作曲线上查出(或用回归方程计算出)试液中L-脯氨酸的含量,mg/L
m4——样品的质量,g
计算结果精确至小数点后第一位。
C7 允许差
同一样品的两次测定结果之差,不得超过平均值的5.0%。
附录D(标准的附录)总D-异柠檬酸的测定
D1 方法提要
在异柠檬酸脱氢酶(ICDH)催化下,样品中的D-异柠檬酸盐与烟酰胺-腺嘌呤-双核苷酸磷酸(NADP)作用,生成NADPH的量,相当于D-异柠檬酸盐的量。在波长340nm处测定吸光度,确定样品中总D-异柠檬酸的含量。
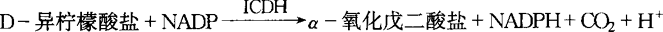
D2 试剂
本试验方法中,所用试剂均为分析纯;实验用水应符合GB6682中二级水规格。
D2.1 组合试剂盒(Cat No.414433)
1号瓶:内含咪唑缓冲液(稳定剂)30mL,pH=7.1;
2号瓶:内含β-烟酰胺-腺嘌呤-双核苷酸-磷酸二钠45mg、硫酸锰10mg;
3号瓶:内含异柠檬酸脱氢酶2mg,5(U)个活力单位。
D2.2 NADP溶液:将1号瓶内的溶液升温至20~25℃,倒入2号瓶中,使2号瓶的物质全部溶解,混合均匀。
D2.3 异柠檬酸脱氢酶溶液:用1.8mL水溶解3号瓶的物质,混合均匀。
D2.4 4mol/L氢氧化钠溶液:称取16g氢氧化钠(GB629),加水溶解,定容至100mL。
D2.5 4mol/L盐酸溶液:量取33.4mL盐酸(GB622),用水定容至100mL。
D2.6 300g/L氯化钡溶液:称取30g氯化钡(GB652),溶解于热水中,冷却后定容至100mL。
D2.7 71g/L硫酸钠溶液:称取71g无水硫酸钠(HG3-123),溶解于水中,定容至1000mL。
D2.8 缓冲溶液:称取2.4g三羟甲基氨甲烷和0.035g乙二胺四乙酸二钠(GB1401),用80mL水溶解。先用4mol/L的盐酸调整至pH7.2左右,再用1mol/L盐酸溶液调整至pH7.0(用酸度计测定),用水定容至100mL。
D2.9 氨水(GB637)。
D2.10 丙酮(GB686)。
D2.11 洗涤溶液:量取150mL水,加入10mL氨水(D2.9)、100mL丙酮(D2.10),混匀。
D3 仪器与设备
实验室常规仪器、设备:
D3.1 紫外分光光度计:带石英比色皿,光程1cm。
D3.2 酸度计:精度0.1pH单位。
D3.3 离心机:转速不低于4000r/min,离心管容积大于80mL。
D3.4 微量可调移液管
10~50μL,允许误差(%):±4.8;
0~1000μL,允许误差(%):100μL,±2.0;500μL,±1.0;1000μL,±1.0。
D3.5 玻璃棒或塑料棒:自制,直径约3mm,一端带钩。
D3.6 分析天平:感量0.1mg。
D3.7 天平:感量10,500mg;1g。
D4 试液的制备
D4.1 果汁型碳酸饮料:称取500g样品于1000mL烧杯中,加热煮沸,在微沸状态下保持5min,并不断搅拌。待二氧化碳基本除净后冷却至室温,称量。用水补足至加热前的质量,备用。
D4.2 浓缩果汁、果汁、果汁饮料、水果饮料:混匀后备用。
D5 分析步骤
D5.1 水解
按表D1规定的取样量称取试液。
表D1
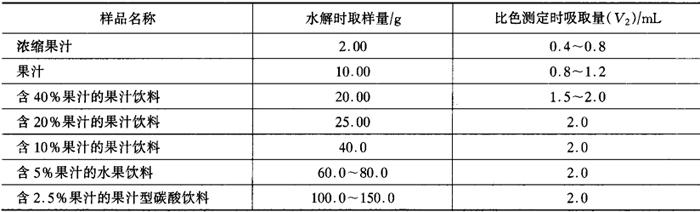
浓缩汁、果汁:将试样称取在50mL烧杯中,加5mL氢氧化钠溶液(D2.4)。用玻璃棒搅拌均匀,在室温放置10min,使之水解。将溶液移入离心管(D3.3)中,用5mL盐酸溶液(D2.5)和10~20mL水,分数次洗涤烧杯,并入离心管中,使总体积约为30mL,搅拌均匀。
果汁饮料、水果饮料、果汁型碳酸饮料:将试液称取在离心管(D3.3)中,加5mL氢氧化钠溶液(D2.4),用玻璃棒搅拌均匀,在室温放置10min,使之水解。加5mL盐酸溶液(D2.5),搅拌均匀。
D5.2 沉淀
D5.2.1 称样量小于或等于25g的试液
在盛有水解物的离心管(D5.1)中依次加入2mL氨水(D2.9)、3mL氯化钡溶液(D2.6)、20mL丙酮(D2.10),用玻璃棒搅拌均匀。取出玻璃棒,按顺序摆放在棒架上。将离心管在室温(约20℃)放置10min,以3000r/min转速,离心5~10min,小心倾去上层溶液,保留离心管底部沉淀物。
D5.2.2 称样量大于25g的试液
按D5.1和D5.2.1的步骤分别制备2~6份沉淀物,然后用约50mL洗涤溶液(D2.11)将2只(或3只、4只、6只,视称样量而定)离心管中的沉淀物合并到1只离心管中,在室温(约20℃)放置10min。以下步骤按D5.2.1操作。
D5.3 溶解
将D5.2中取出的玻璃棒按顺序放回原离心管中,向离心管中加入20mL硫酸钠溶液(D2.7)。将离心管置于微沸水浴中加热10min,同时用玻璃棒不断搅拌。趁热用缓冲溶液(D2.8)将离心管中的内容物转移至50mL容量瓶中。冷却至室温(约20℃)后用缓冲溶液(D2.8)定容至刻度,摇匀。
D5.4 将上述溶液用滤纸过滤,弃去最初滤液,保留滤液备用。
D5.5 测定
D5.5.1 测定条件
波长:340nm;温度:20~25℃;比色浓度:在0.1~2.0mL试液中,含D-异柠檬酸3~100μg。
D5.5.2 测定步骤
按表D2规定的程序和溶液的加入量,用微量可调移液管(D3.4)依次将各种溶液加入比色皿中(微量可调移液管须用吸入溶液至少冲洗一次,再正式吸取溶液),立即用玻璃棒(D3.5)上下搅拌,使比色皿中的溶液充分混匀。
表D2
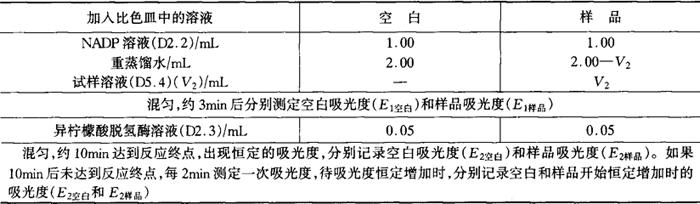
加异柠檬酸脱氢酶溶液后的最终体积为3.05mL。
上述步骤完成后计算△E:
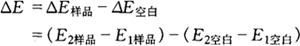
为得到精确的测定结果,△E必须大于0.100。如△E小于0.100,应增加水解时的取样量或增加比色时的吸取量。
D5.5.3 异柠檬酸脱氢酶活力的判定方法
D5.5.3.1 D-异柠檬酸标准溶液
称取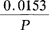 g、含有2个结晶水的D-异柠檬酸三钠盐(C6H5O7Na3·2H2O)基准试剂,精确至0.0001g。置于50mL烧杯中。加水溶解,转移到100mL容量瓶中,用水定容至刻度,摇匀,贮存于冰箱中。此溶液含D-异柠檬酸为100mg/L。
g、含有2个结晶水的D-异柠檬酸三钠盐(C6H5O7Na3·2H2O)基准试剂,精确至0.0001g。置于50mL烧杯中。加水溶解,转移到100mL容量瓶中,用水定容至刻度,摇匀,贮存于冰箱中。此溶液含D-异柠檬酸为100mg/L。
P为D-异柠檬酸基准试剂的纯度(百分含量)。0.0153为系数,按下式计算得出:
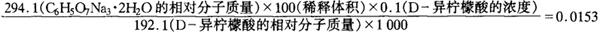
D5.5.3.2 酶活力与标样吸潮的判定
表D3
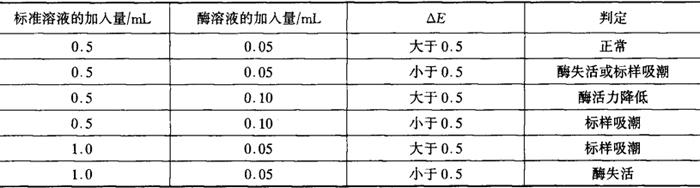
若酶活力降低,应控制测定样品的△E,使之小于标样的△E,以保证测定样品中总D-异柠檬酸反应完全。
D6 分析结果的表述
样品中总D-异柠檬酸的含量按式(7)计算:
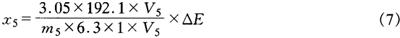
附录E(标准的附录)总黄酮的测定
式中 x5——样品中总D-异柠檬酸的含量,mg/kg
3.05——比色皿中溶液的最终体积,mL
192.1——D-异柠檬酸的相对分子质量,g/mol
V5——试液的定容体积,mL
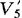 ——比色测定时吸取滤液的体积,mL
——比色测定时吸取滤液的体积,mL
m5——样品的质量,g
1——比色皿光程,cm
6.3——反应产物NADPH在340nm的吸光系数,1×mmol-1×cm-1
D7 允许差
同一样品的两次测定结果之差,果汁含量等于或大于10%的样品,不得超过平均值的5.0%;果汁含量2.5%~10.0%的样品,不得超过平均值的10.0%。
E1 方法提要
橙、柑、橘中的黄烷酮类(橙皮苷、新橙皮苷等)与碱作用,开环生成2,6-二羟基-4-环氧基苯丙酮和对甲氧基苯甲醛;在二甘醇环境中遇碱缩合生成黄色橙皮素查耳酮,其生成量相当于橙皮苷的量。在波长420nm处比色测定吸光度,扣除本底后,与标准系列比较定量。
E2 试剂
本试验方法中,所用试剂均为分析纯;实验用水应符合GB6682中三级水规格。
E2.1 0.1mol/L氢氧化钠溶液:称取4g氢氧化钠(GB629),加水溶解,定容至1000mL。
E2.2 4mol/L氢氧化钠溶液:称取16g氢氧化钠(GB629),加水溶解,定容至100mL。
E2.3 200g/L柠檬酸溶液:称取20g柠檬酸(GB9855),加水溶解,定容至100mL。
E2.4 90%(体积分数)二甘醇溶液:量取90mL一缩二乙二醇(又名二甘醇),加10mL水,混匀,备用。
E2.5 试剂空白溶液:量取20mL氢氧化钠溶液(E2.1)于50mL烧杯中,用柠檬酸溶液(E2.3)调至pH6,转移到100mL容量瓶中,用水定容至刻度,摇匀。
E2.6 橙皮苷标准溶液:称取0.0250g橙皮苷[Hisperidin(由Hesperetin及7-rhamnoglucoside组成),分子式:C28H34O15,相对分子质量:610.6,橙皮苷含量约为80%,本法以80%计],精确至0.0001g,置于50mL烧杯中,加20mL氢氧化钠溶液(E2.1)溶解,用柠檬酸溶液(E2.3)调至pH6,转移到100mL容量瓶中,用水定容至刻度,摇匀。溶液中橙皮苷的含量为200mg/L。此标准溶液需当日配制。
E3 仪器与设备
实验室常规仪器、设备:
E3.1 紫外分光光度计。
E3.2 酸度计:精度0.1pH单位。
E3.3 恒温水浴:温控±1℃。
E3.4 具塞试管与试管架。
E3.5 分析天平:感量0.1mg。
E3.6 天平:感量10mg。
E4 试液的制备
称取一定量混合均匀的样品(浓缩汁2.00~5.00g;果汁10.0g;果汁饮料、水果饮料和果汁型碳酸饮料50.0g)于100mL烧杯中,加入10mL氢氧化钠溶液(E2.1),用氢氧化钠溶液(E2.2)调至pH12。静置30min后,再用柠檬酸溶液(E2.3)调至pH6,转移到100mL容量瓶中,加水定容至刻度,用滤纸过滤,收集澄清滤液,备用。
E5 分析步骤
E5.1 工作曲线的绘制
分别吸取0.00,1.00,2.00,3.00,4.00,5.00mL橙皮苷标准溶液(E2.6)于6支具塞试管(E3.4)中,分别依次加入5.00,4.00,3.00,2.00,1.00,0.00mL试剂空白溶液(E2.5),摇匀。再各加5.0mL二甘醇溶液(E2.4)、0.1mL氢氧化钠溶液(E2.2),摇匀,配制成0.0,20.0,40.0,60.0,80.0,100.0mg/L总黄酮标准系列溶液。
将上述试管置于40℃水浴(E3.3)中保温10min。取出,在冷水浴中冷却5min。用1cm比色皿,以0.0mg/L标准溶液调整零点,在波长420nm处测定各溶液的吸光度。以吸光度为纵坐标,相应的总黄酮浓度为横坐标,绘制工作曲线或计算回归方程。
E5.2 测定
吸取1~5mL试液(E4)于具塞试管中,用试剂空白溶液(E2.5),补加至5mL,加5.0mL二甘醇溶液(E2.4),摇匀后加0.1mL氢氧化钠溶液(E2.2),摇匀。同时吸取一份等量的试液(E4)按上述步骤不加氢氧化钠溶液(E2.2),作为空白调零。以下步骤按E5.1操作,测定试液吸光度,从工作曲线上查出(或用回归方程计算出)试液中总黄酮的含量(c6)。
E6 分析结果的表述
样品中总黄酮的含量按式(8)计算:
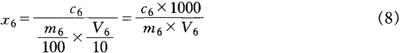
式中 x6——样品中总黄酮的含量,mg/kg
c6——在工作曲线上查出(或用回归方程计算出)的试液中总黄酮的含量,mg/L
V6——测定时吸取试液的体积,mL
m6——样品的质量,g
E7 允许差
同一样品的两次测定结果之差,不得超过平均值的5.0%。