硫酸钙
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第44页(5271字)
一、物理性质
硫酸钙的化学成分,按重量计算,是由70.59%的硫酸根和29.41%的钙组成的。由图1-1-7可以看出,硫酸钙溶解度与温度关系很大;在卤水中,除温度外,与卤水成分有很大关系。但硫酸钙在水或卤水中析出的结晶体含结晶水数,主要与温度高低有关。因此,利用图1-1-7说明在卤水中析出结晶中含结晶水的多少。根据井、矿盐区硫酸钙型卤水在四效蒸发罐中蒸发制盐的数据,在液温57℃以下,析出的是CaSO4·2H2O;在110℃以上,析出是CaSO4;在57~110℃之间,如85℃,析出是CaSO4· H2O。但在稍高于57℃区也析出少量的CaSO4·2H2O,在稍低于110℃也析出少量的CaSO4,这是在生产过程中的实际情况。但在CaSO4·2H2O加热脱水时,所含2分子结晶水中,有
H2O。但在稍高于57℃区也析出少量的CaSO4·2H2O,在稍低于110℃也析出少量的CaSO4,这是在生产过程中的实际情况。但在CaSO4·2H2O加热脱水时,所含2分子结晶水中,有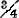 结晶水与硫酸钙晶体结合较松,在128℃时完全失去,转为CaSO4·
结晶水与硫酸钙晶体结合较松,在128℃时完全失去,转为CaSO4· H2O;其余半个结晶水结合紧密,须加热到163℃方能失去,变为无水硫酸钙。现将CaSO4、CaSO4·2H2O和CaSO4·
H2O;其余半个结晶水结合紧密,须加热到163℃方能失去,变为无水硫酸钙。现将CaSO4、CaSO4·2H2O和CaSO4· H2O的物理性质分述如下:
H2O的物理性质分述如下:

图1-1-7 CaSO4-H2O体系相图
T1,T2-CaSO4水合物转化点
(一)无水硫酸钙和2水硫酸钙
无水硫酸钙为无色单斜晶系,天然产的因含有不纯物稍带青色;也有准安定单斜晶系,在1193℃时转为单斜晶系,烧热到1300℃以上,即成灰浆。解离压1200℃时为400Pa,1360℃时为5400Pa。2水盐也是无色单斜晶系,六角柱状,容易成为燕尾形双晶体;普通天然产的为微细结晶集合体,呈纤维状、叶片状、粒状等。这两种硫酸钙在水中溶解度很小,特别是无水盐基本不溶解,在酸、甘油中均溶解,在硫代硫酸钠、氨盐中,则溶解度增大。其余物理数据列下。
线膨胀系数 CaSO4 12~25℃ 0.000025/℃;
弹性模数 CaSO4 3600N/mm2, 极大极小8870~3130kg/mm2;
压缩系数 CaSO4 2.45~1.53 × 106MPa/cm2
磁化率 CaSO4 -49.7 CaSO4·2H2O -74.0×10-6c.g.s.制电磁单位在水中溶解度

熔点 CaSO4 1297℃(1000℃易分解);
电动势 Ca→Ca2++2e+2.76V;
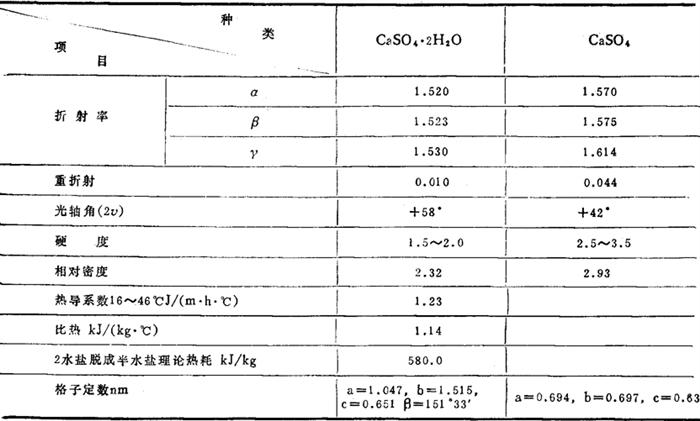
硫酸钙在每种盐类中溶解度
1L海水浓缩至不同浓度时CaSO4析出情况


注:(1)d=1.0911以前,Ca2+析出量0.0286不以CaSO4形式析出。在计算CaSO4析出量时以d=1.0911时,卤水中CaSO4量为基准,此时CaSO4总量为1.1744g。
(2)渤海水中硫酸钙含量为1.274g/L,占总盐量的3.9%,浓度高于地中海水,当海水浓缩到比重1.099,1L海水体积为249.4ml时,硫酸钙开始析出,到氯化钠开始析出时,硫酸钙析出总量约90%,余下的量当卤水浓缩到比重1.2237时,析出64%,到比重1.2289时,析出36%。
在酸中溶解度

磁化率 CaSO4 -49.7×10-6,CaSO4·2H2O-74.0×10-6c.g.s.制电磁单位;
熔融热 J/mol 28032.8;
在卤水溶解度

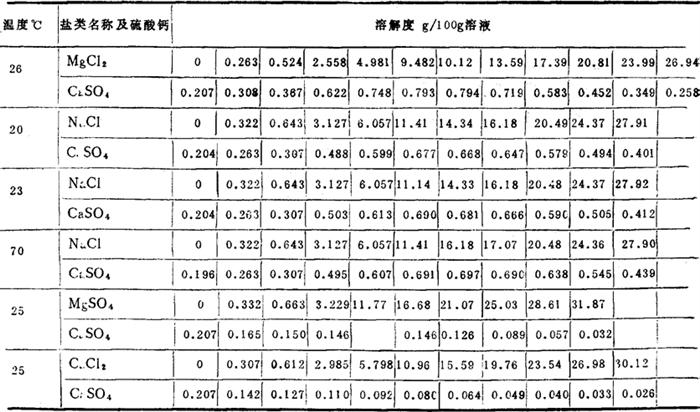
几项热力学数据
电导率

L:电导率S/cm;C:浓度,mo1按CaSO4的二分之一计。
(二)半水硫酸钙
由于加工方法不同,又分为两种:一种是α-型半水硫酸钙,又称高强度硫酸钙,是在0.2MPa蒸汽压力下,加热二水硫酸钙,再用200~240℃的热气进行干燥,并加粉碎,结晶水以液态排出;另一种是β-型半水硫酸钙,是以粉碎到一定程度的二水硫酸钙,在0.1MPa的干燥状态下,经过160~170℃温度均匀煅炒而成,其结晶水以气态排出。两种半水硫酸钙性能不同,用途也不一样。α-型半水硫酸钙吸水率较低,但制品强度较高,适于制造低吸水率模具。β-型半水硫酸钙吸水率大,适于制造吸水率较高的模具,如注浆模具。现将这两种半水硫酸钙物理性质择列如下:
(1)α-型半水硫酸钙(高强度建筑硫酸钙),为白色粉末,有吸水性,与水混合,形成可塑性,易于浇砌的浆体,隔一定时间即固结,并伴有微量的体积膨胀及放热。
晶型 为针状晶体,晶面整齐;相对密度2.72~2.73。
标准稠度的硫酸钙与水之比为100:45~55;标准稠度的浆料,初凝时间不早于5分钟,终凝时间不迟于30分钟;标准稠度的吸水率为35~4%;抗折强度为3MPa;表面显微硬度0.354kg/cm2;抗拉强度3天1.8~3.3MPa,7天2.5~5MPa;水合热α-CaSO4 H2O=CaSO4+
H2O=CaSO4+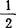 H2O 0.795kJ/mol。
H2O 0.795kJ/mol。
热力学数据:

(2)β-型半水硫酸钙(烧硫酸钙)除吸水率低外,有些情况与α-型近似,现将不同处列下:
晶型 无定型,多为屑粒状;比重2.67~2.68;
标准稠度硫酸钙与水之比为100:70~80;标准稠度灰浆,初凝时间不早于5分钟,终凝时间不迟于20分钟;标准稠度制品吸水率50~60%;抗折强度15kg/cm2;溶解热1mol溶于18℃的无限水中14.9kJ/mol;水合热CaSO4·2H2O=β-CaSO4· H2O16.84kJ/mol,CaSO4·2H2O=γ-CaSO4·
H2O16.84kJ/mol,CaSO4·2H2O=γ-CaSO4· H2O 17.78kJ/mol,β-CaSO4·
H2O 17.78kJ/mol,β-CaSO4· H2O=CaSO4+
H2O=CaSO4+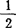 H2O 1.74kJ/mol,γ-CaSO4·
H2O 1.74kJ/mol,γ-CaSO4·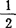 H2O=CaSO4+
H2O=CaSO4+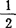 H2O 2.68kJ/mol。
H2O 2.68kJ/mol。
热力学数据

表面显微硬度0.219kg/mm2;抗拉强度(1天)8kg/cm2(7天)16kg/cm2;
二、化学性质
无水半水和2水硫酸钙,加热到1000℃即分解为SO2和CaO;在浓硫酸中,则溶解为硫酸氢钙;与氨和二氧化碳反应,生成碳酸钙沉淀和硫酸氨溶液;在80℃温度下,与钾盐反应生成钾石膏,即K2SO4·CaSO4·H2O或K2SO4·5CaSO4·H2O;以上均是一般常见的化学反应。利用2水石膏还可生产硫酸和水泥。
CaSO4·2H2O+C→CaS+CO2+2H2O(在700℃左右)
CaSO4·2H2O+CaS→2CaO+2SO2(在900℃左右)
硫酸钙与碳酸铵反应则产生碳酸钙沉淀和硫酸铵溶液
CaSO4·2H2O+(NH4)2CO3→CaCO3↓+(NH4)2SO4
CaO在烧结区与窑中添加的SiO2Al2O3和Fe2O3反应,得到水泥熟料,SO2通过催化剂氧化成SO3,吸水化合成硫酸。
三、用途
未煅烧的无水硫酸钙,可作水泥的缓凝剂,用量很多;在农业上用作肥料、动物饲料;在食品、医药中用作钙的来源;在工业上用作滤过剂、惰性稀释剂、水的净化剂,并可生产硫酸、水泥、钾盐、硫酸钙等;在玻璃生产上,用作氧化剂、精制剂、去沫剂。半水硫酸钙,用作建筑材料,如硫酸钙板条,各种模具等。煅烧的无水硫酸钙,可用作干燥剂、杀虫剂运载体2水硫酸钙,可用作生产硫酸铵原料,据建材工业规划院调研资料,到2000年我国水泥工业需用硫酸钙量达千万吨以上。此外,根据新型建筑材料公司提供的数据,建筑制品还需硫酸钙500万吨。
四、质量标准
我国1980年制定了食品添加剂硫酸钙的国家标准(GB1892-80);1982年建筑材料工业部颁布了用在各方面的部标准;1985年又制定了用于水泥中的石膏(CaSO4·2H2O)和硬石膏(CaSO4)国家标准。以上三个标准的石膏,均指天然石膏。建材工业规划院1983年研究有关试验资料后,认为制盐工业所产的盐石膏,在成分和性能方面,与天然石膏基本一样。因此以上三个标准,适用于制盐工业。现将以上三个标准分列于下,作为参考。
(一)食品添加剂硫酸钙国家标准(GB1892-80)
适用于天然石膏矿除净杂质、泥土、经煅烧磨粉的硫酸钙(又名煅石膏),在食品加工中作凝固剂。
分子式:CaSO4·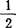 H2O 分子量:136.14(按1977年国际原子量)。
H2O 分子量:136.14(按1977年国际原子量)。
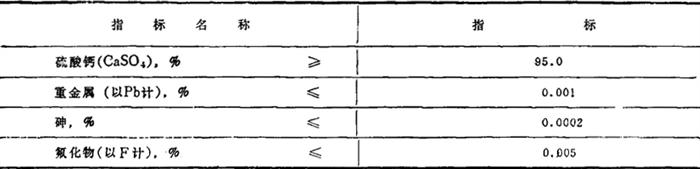
外观为白色粉末。质量符合表1-1-30的要求。
表1-1-30
(二)中华人民共和国建筑材料工业部1982-02-26颁布的石膏标准 石膏是一种以二水硫酸钙(CaSO4·2H2O)为主要成分的矿石。可分为纤维石膏、透明石膏、雪花石膏、普通石膏。其分级与用途见表1-1-31。块度不大于500mm。附着水含量不应超过5%。
表1-1-31 石膏分级与用途
(三)用于水泥工业的石膏和硬石膏的国家标准(GB5483-85)
1.品位 以二水硫酸钙(CaSO4·2H2O)和无水硫酸钙(CaSO3)为主的天然矿石。硬石膏中的无水硫酸钙(CaSO4)与二水硫酸钙(CaSO4·2H2O)之重量比应大于1。
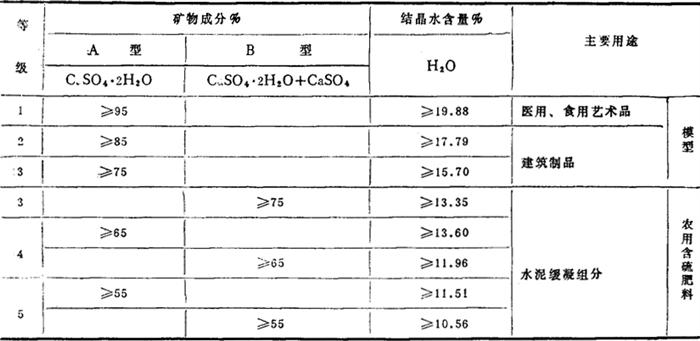
2.等级 按品位各分为三级,见表1-1-32。
表1-1-32 石膏和硬石膏的等级和品位

注:当品位大于或等于55%、小于60%时的使用问题由供需双方协商;杂质不得含有害于水泥性能的杂质和混入外来夹杂物;附着水不得超过4%。
表1-1-33 美国联邦电信委员会(F.C.C.)食品级CaSO4·xH2O标准Ⅲ-81

