蒸发终止沸点
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1574页(3498字)
在蒸发浓缩过程中,混合卤中的氯化钠和硫酸镁不断结晶析出,氯化钾和氯化镁的浓度不断升高,料液沸点也随之升高。终止蒸发时的料液沸点称为终止沸点,生产上常通过控制终止沸点间接地控制蒸发完成液的浓度。对蒸发过程的工艺要求是:氯化钠和硫酸镁要充分析出,但不允许有氯化钾析出;固液分离后的澄清液中,光卤石应尽量接近饱和,以不析出为限。因此,选择适宜的终止沸点是蒸发工艺中的关键。
(一)蒸发过程的理论分析
蒸发终止浓度过高会使光卤石达到饱和而析出,造成钾的损失;蒸发终止浓度过低,氯化钠和硫酸镁析出不充分,影响光卤石的产量和质量。根据蒸发工艺要求,完成液的组成应接近氯化钠、硫酸镁和光卤石三盐共饱点,当蒸发完成液的温度降至保温固液分离温度时,以光卤石恰好饱和为最理想。现根据相图理论对蒸发过程中析盐规律、析盐量及最佳液相组成进行分析。
卤水蒸发时沸点在120℃以上,目前仅有110℃的相图数据,故只能采用110℃的相图作近似分析。高温固液分离温度一般在90~110℃之间,现选择100℃作为保温固液分离温度。将100℃及110℃两组Na+、K+,Mg2+//Cl-,SO42--H2O五元交互体系平衡相图绘在一起进行分析,如图6-2-7。

图6-2-7 100℃和110℃时Na、Kt、Mg2+//Cl-、SO42-五元交互体系平衡相图
实线为110℃的相图;虚线为100℃的相图;A点为MgSO4·H2O在干
盐图上的固相点;a点为MgSO4·H2O在水图上的固相点;bN为B110℃
点在NaCl盐图上的对应点;水图上各小写字母点及NaCl盐图止带(,)
的写字母点,分别与干盐图上各大写字母点相对应
LÖw;Na2SO4·MgSO4· H2O
H2O
Mg·1:MgSO4·H2O
Car:KCl·MgCl2·6H2O
Lang:K2SO4·2MgSO4
Bi:MgCl2·6H2O
某混合卤组成如下:
°Bé ℃ MgSO4 MgCl2 KCl NaCl
30.9 30 72.54 216.27 20.07 69.93
换算成耶涅克指数为:
Mg2+ SO42- 2K+ 2Na+ H2O
79.6 16.18 3.72 16.55 1370
将上述组成的混合卤标在图6-2-7上,在干盐图上体系点为P,在水图上体系点为M0。P点落在MgSO4·H2O结晶区内,故混合卤蒸发时首先伴随NaCl结晶析出的是MgSO4·H2O;继续蒸发当液相点到达C点时,KCl·MgCl2·6H2O饱和。由100℃的相图看出:MgSO4·H2O、NaCl和KCl·MgCl2·6H2O的三盐共饱线FG比110℃的三盐共饱线DE更靠近P点,若高温蒸发时液相点到达C点,到保温固液分离温度降到100℃时必有光卤石析出,造成钾盐损失。显然,高温蒸发时液相组成必须在C点之前,当温度降到100℃时液相组成恰好落在N点上是最佳点。究竟高温蒸发时液相点控制在C点之前什么位置最好,可用图解法确定如下:
高温蒸发时液相组成点应在C点之前,并在AC直线上,水图上该点应在b110℃C直线上。当降到保温温度时,液相点应在NaCl、MgSO4·H2O、KCl·MgCl2·6H2O三盐共饱线的N点,水图上该点应在an线上。显然,能同时在两条直线上的点,必是两直线的交点。故水图上b110℃C线与an线的交点1就是高温蒸发的最佳终止液相点,投影在干盐图上为L点。此时体系点在水图上已由M0点降到M点,因M点仍在M1M2之间,为NaCl和MgSO4·H2O共同析出阶段。整个蒸发过程是:混合卤的体系点随着蒸发水分及NaCl和MgSO4·H2O的析出由M0→M点。到达M点后停止蒸发,液相点为1,降到保温温度100℃的过程中,NaCl和MgSO4·H2O继续析出,液相点由l→n点,到n点后光卤石刚好饱和而又不析出。
通过计算可知,蒸发到液相组成为L点时,NaCl和MgSO4的析出率已达90%左右,为下一工序制得优质光卤石创造了有利条件。
(二)终止沸点、保温温度、MgCl2/KCl比值之间的关系
根据蒸发的工艺要求,澄清液应是氯化钠、一水硫酸镁和光卤石的共饱溶液。根据相图可知:在压力不变的情况下,处于三盐共饱线上的体系只有两个自由度,即温度(此时就是保温温度)和卤水中某一组分的浓度。为便于工艺分析,选择卤水中MgCl2/KCl比值代替某一组分的浓度较为方便。这样当保温温度和MgCl2/KCl比值这两个自由度确定后,澄清液的组成也就确定了,同时澄清液的沸点及波美度也有了确定的数值。生产上通过测量蒸发完成液的终止沸点及澄清液的波美度,来控制澄清液的组成。有关数据列于表6-2-5及表6-2-6。根据表6-2-5数据绘制成图6-2-8、6-2-9、6-2-10、6-2-11,根据表6-2-6数据绘制成图6-2-12和图6-2-13。
表6-2-5 不同温度、不同MgCl2/KCl比值下,NaCl,MgSO4·H2O,KCl·MgCI2·6H2O共饱液组成
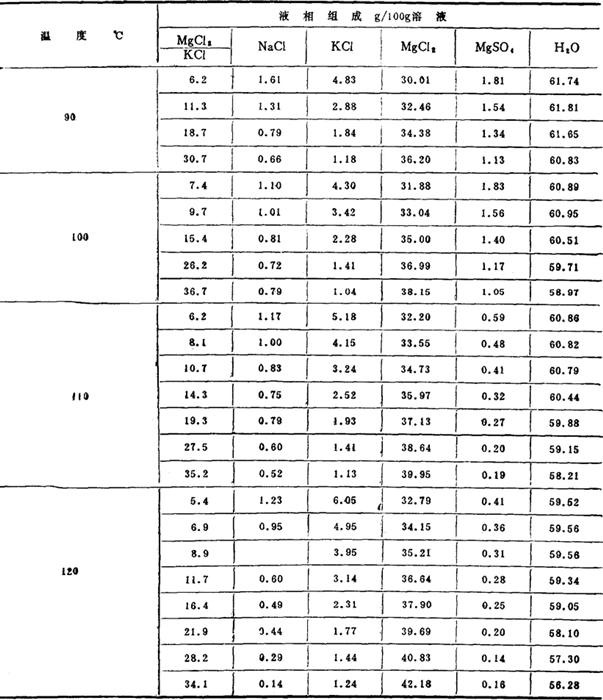
表6-2-6 蒸发终止沸点与保温温度及卤水中镁钾比值的关系
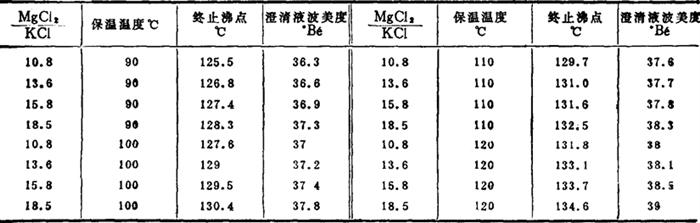
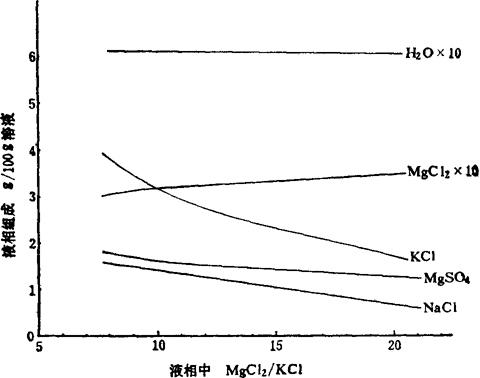
图6-2-8 90℃时NaCl,MgSO4·H2O,KCl·MgCl·6H2O共饱和时的液相组成与镁钾比值的关系

图6-2-9 100℃时NaCl,MgSO4·H2O,KCl·MgCl2·6H2O共饱和时的液相组成与镁钾比值的关系

图6-2-10 110℃时NaCl,MgSO4·H2O,KCl·MgCl·6H2O共饱和时的液相组成与镁钾比值的关系

图6-2-11 120℃时NaCl,MgSO4·H2O,KCl·MgCl·6H2O共饱和时的液相组成与镁钾比值的关系

图6-2-12 混合卤MgCl2/KCl比值
t-保温温度

图6-2-13 混合卤MgCl2/KCl比值与终止沸点的关系(澄清液NaCl,KCI·MgCl2·6H2O,MgSO4·H2O处于共饱和)
由表6-2-5的数据看出:在相同的温度下,MgCl2/KCl比值越高,三盐共饱的溶液中KC1浓度越低;MgCl2/KCl比值一定时,温度越高,溶液中KCl的浓度也越高。所以在选工艺条件时,应将保温温度控制的稍高一些,MgCl2/KCl比值稍低一些。
例如,混合卤中MgCl2/KC1比值为10.5,保温温度为100℃时,由图6-2-13可查出相应的终止沸点为127.7℃,生产上可控制为128℃。