用NS—B盐制取硫酸钾
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1687页(1107字)
1956年日本中山道夫首先研究了在苦卤体系中加入Mg(OH)2,能生成复盐Na2SO4·2MgSO4·Mg(OH)2·2H2O和K2SO4·2MgSO4·Mg(OH)2·2H2O。中山道夫称第一种复盐为NS-A盐,称第二种复盐为NS-B盐。1960年中山道夫又发表了由NS-B盐制硫酸钾的论文。在此基础上我国薛士栋同志于1963年发表了从盐田苦卤中制取NS-B复盐的论文。NS-B盐是一种不含氯根的有价值的钾镁肥,也可由NS-B盐制取硫酸钾。
根据薛士栋同志的研究结果:
1.苦卤预先浓缩,充分除去NaCl,又不使MgSO4·H2O析出。故不同组成的卤水浓缩程度有一定的限度,见表6-6-3。浓缩后卤水冷却到75℃左右。
表6-6-3 不同成分苦卤浓缩程度和除去NaCl的限度

2.制备NS-B盐的最适宜条件:
Mg(OH)2用量为卤水中KCl当量的0.8倍
卤水成分:MgSO4/MgCl2≤0.6
KCl/NaCl≥1.0
MgSO4/KCl=2.5~3.0
反应温度:90~100℃
反应时间:4~6h
在上述条件下可制几乎不含NaCI的NS-B盐,钾的回收率为50~65%。
中山道夫由NS-B盐制取硫酸钾的流程见图6-6-5。
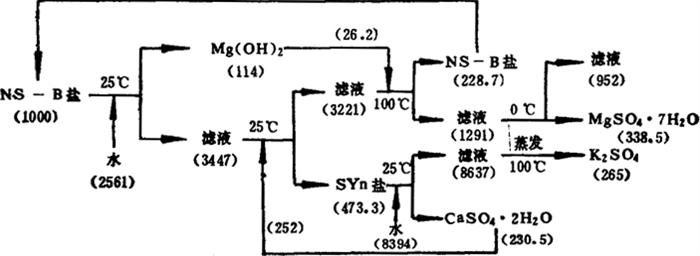
图6-6-5 由NS-B盐加水分解制取K2SO4的工艺流程及物料流量
注:Syn一钾石膏K2SO4·CaSO4·H2O
由NS-B盐加水分解,并添加CaSO4·2H2O制得中间产品钾石膏K2SO4·CaSO4·H2O,再由钾石膏制得K2SO4。这种方法钾的收率为73.4~90.0%,制得硫酸钾的纯度是91.24~99.87%。本方法的特点是在过程中添加或析出的盐类能够全部循环使用。