补体结合反应
出处:按学科分类—农业科学 中国农业出版社《兽医微生物实验诊断手册》第182页(7032字)
抗原与相应抗体结合后能激活补体,如抗原为红细胞,则红细胞被裂解,出现溶血反应。如为可溶性抗原,则补体被结合,但此种反应肉眼不易察觉,如操作时补体等定量,作用后再加入指示系统,即致敏红细胞,即可根据指示系统是否出现溶血反应以判定反应系统中是否存在相应的抗原和抗体。参与补体结合的抗体主要为IgG和IgM,IgE和IgA通常不能结合补体。
补反根据反应量不同有全量法、半量法、半微量法和微量法之分,其中以半微量法(亦称常量法)和微量法应用最广,根据稀释的试剂不同又有稀释抗体法、稀释抗原法和稀释补体法三种。此外还有固相补体结合试验和间接补体结合试验等方法。由于一个抗体分子与抗原结合后,可激活几百个补体分子,使反应明显扩大。因此是一种比较敏感的方法,已在传染病诊断中广为应用。
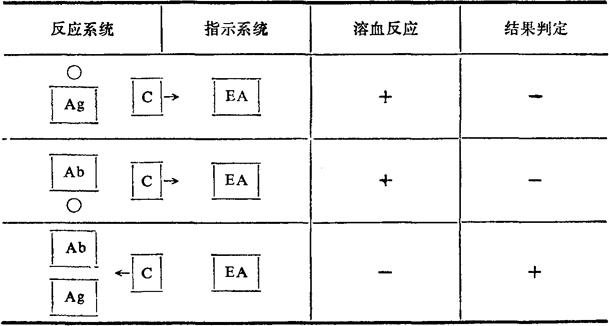
图9-8 补体结合反应原理
Ab.抗体Ag.抗原C.补体EA.致敏红细胞
补反为定量定性反应,试验时需先作预备试验测定溶血素,补体和抗原的最适用量(工作单位),然后进行正式试验。
一、材料准备
1.抗原 病毒、细菌、立克次体和原虫等经适当处理后,均可作为补体结合抗原。病毒材料因含有大量细胞碎片,脂类物质等,其中有些物质有抗体作用,必须除去。故对原始病料应进行适当提纯,以提高抗原的特异性。病毒抗原通常用反复冻融后离心沉淀,除去细胞碎片,或用丙酮、乙醚等抽提,以除去脂类物质,以去氧胆酸钠和吐温80处理,使病毒粒子分散,病毒抗原逸出,亦可应用其他理化方法加以提纯。细菌抗原通常用酚法提取菌体抗原(脂多糖),钩端螺旋体、锥虫等,通常用菌(虫)体裂解抗原,现有少数商品化抗原可供购用。
在制备病毒、立克次氏体、某些原虫的抗原时,需用同一未接毒的正常组织、细胞培养或鸡胚培养液,用同法处理作为正常对照。
2.血清 被检血清应在空腹时采取,以免血清中混有脂类物质,出现抗补体作用。阳性血清通常用兔和豚鼠制备,也可采用康复血清。采血需用干燥灭菌注射器,或用前以生理盐水漱洗,血清析出后及时离心分离,以免溶血。
血清用前要加热灭活,灭活温度视动物种类不同而异,牛、马和猪的血清一般用56~57℃,山羊和绵羊血清用58~59℃,驴、骡血清为63~64℃,兔血清用63℃,人血清用60℃,用60℃以上温度灭活时可先将血清1∶2或1∶5稀释,以免凝固、变性,灭活时间一般为30min。
有些阳性,阴性血清已商品化,可购用。
3.补体 通常用豚鼠血清作补体,为避免个体差异,一般用3~4只成年雄性豚鼠血清混合使用,取血前一天下午禁食,次日空腹采血,取血后放入4℃冰箱,2~3h内分离血清,立即分装小瓶,于低温冰箱冻结保存,可应用1个月,冻干补体可保存2年,新鲜补体室温下保存期只24h左右。
4.1%绵羊红细胞 采自健康绵羊,加入等量阿氏(Alselver′s)液,4℃冰箱可保存1个月,用前吸所需量,加5~10倍生理盐水,反复洗涤3次,最后用3,000rpm,20min离心,按积压红细胞量加生理盐水配成所需浓度的红细胞悬液,或1%、或2%、或4%。
阿氏液的配制为葡萄糖2.05g、柠檬酸钠(Na3C6H5o7·2H2O)0.80g、NaCl0.42g、蒸馏水100ml。溶解各物后,以10%柠檬酸调节pH至6.1,过滤,分装,10磅10min灭菌,4℃保存备用。
5.溶血素 系用绵羊红细胞多次免疫兔制成,可从生物药品厂购得。
6.稀释液 有生理盐水、钙镁盐水、巴比妥缓冲液(VB液)、明胶巴比妥缓冲液(GVB液)等。
钙镁盐水的配法:先将10g的MgCl2·6H2O与4g的CaCl2· 2H2O溶于100ml蒸馏水中,将此钙镁液1ml加到生理盐水999ml中即为钙镁盐水。
巴比妥缓冲液的配制:此液成分为巴比妥钠3.75g、二乙基巴比妥酸5.75g、NaCl85g、蒸馏水2000ml。配制时先将巴比妥钠及NaCl溶于1000ml蒸馏水中,另取二乙基巴比妥酸(即巴比妥)溶于500ml热蒸馏水中(加热助溶),然后二液缓慢混和,最后加蒸馏水达2000ml即成。
明胶巴比妥缓冲液的配制;取上述巴比妥缓冲液200ml,加上0.1M氯化镁溶液5ml、0.03M氯化钙溶液5ml、2%明胶溶液50ml,加水至1000ml即成。
无论采用那种补体结合反应,从预备试验开始一直到正式试验,从头到尾要求做到稀释液一致、血细胞浓度一致、各成分(抗原、血清、补体、溶血素、血细胞)所加入的量一致、每管最后的总量均同(或为0.6ml,或为6滴,或为2.5ml)。有些管作为对照,省去了某成分,应以稀释液补充其省去的量。
配制各溶液,亦可以无离子水代替蒸馏水。
二、补体结合试验术式之一(常量、稀释抗体法)
(一)预备试验
表9-2 溶血素稀释法 单位:ml

1.溶血素滴定取溶血素(含50%甘油)0.2ml加9.8ml生理盐水,即100×溶血素基础液,按下表进行稀释。
表9-3 溶血素滴定

取上述各稀释液0.1ml分别加于8支小试管中,每管都加稀释60×的补体[0.1ml补体加5.9ml稀释液(此处为钙镁盐水,下同)]0.2ml,各管再补加稀释液0.2ml(目的是使每管总量与正试试验同,以达到0.6ml),最后每管都加1%红细胞0.1ml,同时另取3支小试管作对照管,所加各物如下表所示,置37℃水浴观察结果。
第9、10、11管均不应溶血,因为第9管无补体,第10管无溶血素,第11管二者均无。如第9管溶血应换溶血素、第10管溶血应换补体、第11管溶血则9、10都会溶血应换稀释液或血细胞,正常情况下这三管都不应也不会发生溶血。在第9、10、11三管不溶血条件下,红细胞全部溶解的溶血素最大稀释度为1个溶血素单位,表中假设结果为10000×。以后的试验(包括补体滴定、抗原滴定、正式试验等)均用2个溶血素单位,假设一个溶血素单位为稀释10000×的溶血素0.1ml,则以后各试验均用5000×溶血素0.1ml。
正式试验前2单位溶血素加等量1%红细胞悬液混合后,在室温下放置15~30min,即为致敏红细胞。
2.补体滴定 取三列试管,每列6支,按下表加入各种成分,第一列加标准抗原,第二列加正常(组织)抗原为对照,第三列不加任何抗原而加钙镁盐水,各列均加入不同量的补体,37℃水浴30min后,加入致敏红细胞0.2ml,振摇后37℃水浴30min,判定结果。
表9-4 补体滴定术式

在有标准抗原、正常抗原、无抗原的三排管中,能使红细胞全部溶解的最小补体量为一个补体单位,上例60×、0.12ml为1个单位(如上例第4管为“微不溶”,其他各管照旧,则1个补体单位为60×、0.14ml)。正试试验取2个单位0.2ml为补体工作量。计算法为:

上例补体,用钙镁盐水作50×稀释,即为2单位/0.2ml,也就是一个工作量的补体。
3.抗原滴定 取81支试管排成9×9的方阵。另取14支试管,将标准阳性血清和标准抗原分别作倍比稀释,自2×至128×7个稀释倍数,按下表加入方阵,每管0.1ml,然后分别加入补体0.2ml(2单位),并补足对照管中的钙镁盐水量,将各管摇匀,置37℃水浴1h,病毒抗原多用4℃过夜,次日取出在水浴中加温至37℃。各加入致敏血细胞0.2ml,振摇混合后,置37℃水浴30min,观察结果。
表9-5 抗原效价滴定举例

* 4——完全抑制溶血,即不溶血。
3——75%抑制溶血,即25%溶血。
2——50%抑制溶血,即50%溶血。
1——25%抑制溶血,即75%溶血。
0——完全溶血。
能与最大稀释倍数的阳性血清发生完全抑制溶血的抗原最大稀释倍数,为1个抗原单位,反之亦然。
上例:抗原32×,阳性血清16×各为1个单位,正式试验时,采用2或4个单位。即抗原用16×或8×,阳性血清用8×或4×。
(二)正式试验 每一待检血清取10支试管,第1~6管加不同稀释的待检血清,7、8二管为正常组织的抗原对照,9、10二管为血清抗补对照。按表加入反应的各种成分,振摇后,置37℃水浴1h,或置4℃冰箱越夜,试前加温至37℃,然后加入致敏红细胞0.2ml,振摇后,置37℃水浴30min,观察结果,以抑制溶血在2以上的血清最大稀释倍数为该血清的补体结合效价,下例该血清效价为32×。另取2管加阳性血清(1单位)和阴性血清(2×)作为每次试验的共同对照。
另取8支试管按下表加入各种成分,作为补体单位对照和阳性血清、阴性血清对照,如结果与表中预期结果不符时,试验作废,找出问题,重做。
表9-6 正式试验术式

表9-7 正式试验中补体对照和阳性血清阴性血清对照

三、补体结合试验术式之二(微量,稀释补体法)
(一)材料准备
1.巴比妥缓冲液(VB原液)及明胶巴比妥缓冲液(GVB液),见前。
2.4%致敏红细胞悬液 抗凝绵羊血经3000rpm离心10min后,吸去上层血浆和白细胞层,用5~10倍GVB液洗涤,反复4次,用GVB液配成4%红细胞悬液,用前加等量2单位(对4%红细胞的)溶血素,室温放置10min,再置37℃水浴10min,即成致敏红细胞悬液。
(二)预备试验
1.溶血素滴定 将溶血素稀释成1∶1000至1∶9000,分别加入第1~9孔,每孔1滴,然后依次加入40×补体,每孔2滴;GVB液每孔2滴,4%致敏红细胞悬液每孔1滴,置37℃水浴作用10min,观察结果,红细胞全部溶解的溶血素最大稀释度为1个溶血素单位,正式试验时,用2个溶血素单位。
2.补体滴定 取9支试管按下表加入GVB液,吸补体1ml加入第1管,混匀后吸7ml于第2管,依次顺序稀释至第9管。
表9-8 补体稀释法

反应在96孔微量滴定板上进行,用标准滴管吸上述稀释补体于1~9孔,每孔2滴,每吸一次,用GVB液冲液两次,然后加入已知阴性抗原,各孔1滴。2×标准阴性血清,各孔1滴,置4℃冰箱过夜,翌日取出,各孔加入致敏红细胞悬液2滴,振摇后,置37℃水浴作用30min,观察结果。
假设测得的结果如表9-9。
表9-9 测定结果

3.标准比色管的制备 为了提高判定的正确性,需先配成标准比色管,分别滴入1~11孔,每孔6滴,作为标准。各试验孔溶血程度与标准对比后,记录溶血值。制备标准比色管时,需先配制红细胞溶血液和3倍稀释的致敏红细胞悬液。
表9-10 标准比色管配制和溶血程度的判定

(1)红细胞溶血液 致敏了的4%红细胞悬液2ml加蒸馏水6ml,冻融数次使红细胞完全裂解。
(2)3×致敏红细胞悬液 取2ml致敏了的4%红细胞悬液,加6ml GVB液,并加甲醛2滴,以防止溶血。
4.抗原滴定 将阳性抗原和阴性对照抗原分别与标准阳性血清和GVB液作用,用9个不同稀释度的补体如下表作抗原滴定。
表9-11 抗原滴定表

假如判读各孔的溶血值(与标准比)如表9-12。
表9-12 溶血值判定

第一列溶血值总和是8.1,第二列是2.7,二者差为5.4(有阳性血清存在时,阳性抗原与对照抗原的差);第三列、第四列溶血值总和均为3.5(无阳性血清存在时,阳性抗原与对照抗原的差)。这两个差(5.4与0)是抗原的效价。要求三列与四列的差是零,否则表明抗原不好;并要求一列与二列的差大于5。
5.正式试验 在96孔板上进行,被检血清用2×或5×稀释,用前灭活,每一检样做二列,如以上述补体滴定的例子,每列做7个孔,1~7孔的补体稀释度同补体稀释法的3~9管。操作时按下表加入各成分。
表9-13 正式试验术式和结果举例

试验应设阳性血清和阴性血清对照,阳性血清对照的效价(阳性抗原与对照抗原的差)应在5.0以上,阴性血清对照应为0。以第一列的溶血值和减去第二列的溶血值和,即为该被检血清的效价,效价在0.8以上者判为阳性,在0.2以下者判为阴性。0.3~0.7者为可疑,应进行重试,重试后仍在0.3以上者判为阳性,在0.2以下者判为阴性。
四、间接补体结合试验
禽类抗体与抗原结合后,不能结合哺乳动物补体(如豚鼠补体),故应改用禽类补体,如鸭补体;猪血清中含有前补体因子,能增强补体的溶血作用,故亦不能直接进行补反。为此,设计了一种间接补反试验,以检测禽类和猪血清中的抗体。
进行间接补反时,除常规阳性血清,阴性血清和待检血清外,尚需制备一种能与抗原进行常规补体结合试验的指示抗体。例如需作猪瘟间接补体结合试验时,可用猪瘟兔毒免疫家兔制备兔抗猪瘟血清,作指示抗体。
试验时,先将不同稀释度的待检血清与1工作单位的抗原37℃作用30min,然后加入1工作单位的指示抗体和补体,最后加入致敏红细胞,如待检血清中含有抗体,则抗原被结合,指示抗体不能与抗原结合,补体不被消耗,故加入溶血系统后,出现溶血现象,本法亦称补体结合抑制试验,其原理见图9-8。
间接补体结合试验的操作术式同常规方法,但需增加一个待检血清作用阶段,通常在待检血清与抗原混合后,需在37℃作用30min,或4℃作用8h,然后再加入指示抗体和补体,以下过程与常规补体结合试验相同,结果判定以溶血为阳性,不溶血为阴性,出现溶血的血清最大稀释倍数为该血清的效价。
本法溶血素、补体和抗原的滴定同常规法,但本试验中抗原用量不能太大,一般较1个单位的抗原提高50%浓度,例经滴定1个抗原单位为32×,则本试验的抗原工作浓度为32/1.5=21.3。

图9-9 间接补体结合试验原理
Ag.已知抗原 Ab1.待检血清中抗体 Ab2.指示抗体 C.补体 EA.致敏红细胞