光自养细胞选择
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第252页(5780字)
高等植物的培养的细胞具有成熟基粒的叶绿体和保持光合作用活性。光促进绿色细胞的生长。但大多数的绿色细胞没糖时不能生长。人们已经做过许多培养光自养的绿色组织的试验,在短时期内获得一些成功,或者生长速度较慢,缺乏强有力的自养生长,曾被认为是由于这些绿色细胞叶绿素含量低和光合作用活性低之故。
Yamacla和Sato(1978)从烟草(Samsun品种)和金雀花的光混合营养培养物中选到了含高叶绿素细胞,成功地进行了光自养培养。Berlyn和Zelitch(1975)从烟草的黄色突变体的花药培养得到白的和绿的愈伤组织,绿的愈伤组织有很快净光合作用。Huseman和Barz(1977)对光自养条件下能生存的红藜细胞进行连续转代培养,直至获得能快速生长的细胞悬浮物。这些研究表明:不同的类型的细胞培养物光合作用能力不同。
培养的细胞的叶绿素含量通常当作选择光自养细胞标准,但它不是自养的最好标准。因为不能预测绿色的黄檗树细胞低光自养生长的绿色细胞。光合作用释放的O2的测定表明黄檗树细胞光合作用的活性非常低。然而在光混合培养中,金雀花细胞的光合潜力与它们的光自养生长有密切相关。图11-3已证实了要想成功地建立光自养的培养物,选用具有高的光合作用潜力的细胞的重要性。

图11-3 培养的绿色细胞的氧气交换
用氧电极追踪呼吸作用吸氧和光合作用放氧。用lmM浓度的NaHCO3来增加CO2。培养的细胞(0.1g鲜重)悬浮在20mM的磷酸缓冲液中,pH=7.8.on:开灯:off:关灯.
(一)光自养培养成功的主要因素
1.植物材料 几乎植物的各部分都可用来诱导愈伤组织。但常用种子和幼苗,并易成功。在光照情况下,可从许多种的植物诱导愈伤组织,通常由不同程度绿色的细胞组成,尽管同一块组织上诱导产生,但形成叶绿体的潜力不同。据报道,至今仅有6种植物的细胞可以很好地光自养生长。这6种是:红藜、金雀花、天仙子、烟草JWB Su/Su、Samsum烟草和菠菜。
2.培养基 培养基的组成对选择绿色细胞是重要的。2,4-D是一种诱导和增殖愈伤组织的常用生长素。但是2,4-D能抑制叶和愈伤组织中叶绿素合成。lAA是一种天然的生长素,是有利的,但在光照下容易分解。NAA比起IBA或2,4-D更能有效地促进叶绿素的合成。细胞分裂素与生长素一起调节细胞分化,它能促使非绿色的愈伤组织变绿。因此经常在培养基中加入BA或激动素。约10μm的NAA和1μm的BA与Liasmaier-Skoog的基本培养基相结合最好,但可能不是对所有种类的绿色愈伤组织的诱导和增殖都必须的。但到目前为止,是最有用的。
对于绿色细胞的培养来说,愈伤组织诱导时,培养基中加有机碳源是需要的。但是加糖,尤其是光合作用的产物——蔗糖,就抑制了培养的细胞的光合作用活性和转绿。在愈伤组织诱导后,选择的绿色细胞必须尽快地转移到光自养培养基,不然会丧失所需的特征。
3.培养条件 光自养培养成功的基本因素是选用有高的光合作用潜力的细胞系和有利于光合作用的培养条件,就是适当的光强和较高的CO2浓度。高的CO2浓度(大约1-2%v/v)是把补充了CO2的空气通过蒸馏水再通入培养瓶,来维持较高的CO2浓度(大约1-2%v/v),空气的进口和出口都用棉花塞起来(图11-4)。另一种方法是把补充的CO2的气体通入放有培养皿或者用棉花和海绵硅胶塞住的培养瓶的透明小室中。另一种保持培养物高CO2浓度方法,是用2M KHCO3/K2CO3缓冲液当作CO2的保存剂,然后把所有的细胞培养在适宜的温度(大约26℃)和合适的光照(6000-10000lx)下。
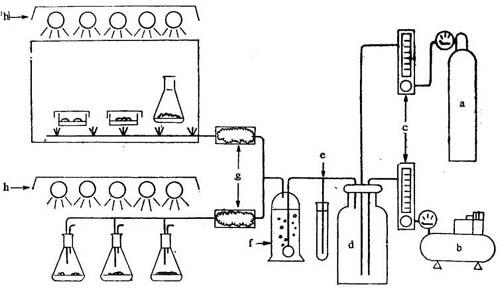
图11-4 选择具有高的光合作用潜力的培养细胞系统
a:CO2气体b:空气压缩机c:流量控制d:混合气体贮藏器e:安全阀f:蒸馏水(用来洗气体)g:气体过滤器(棉花过滤器等)h:光照。绿色细胞无明显的光合作用活性。
在发酵罐中,减少O2的供应对光自养培养也是重要的,用减低通气的速度,或用通入加有N2,使氧分压降低的空气来减少O2的供应,这样加强了光自养生长。Dalton(1980)取得了类似结果,他用控制溶解的氧气浓度办法连续地培养菠菜属光自养细胞。
(三)生长和叶绿素含量的测定
用滤纸把细胞的过多水吸去后才能测定鲜重。在60℃的情况下,烘二天后,才能测出样品的干重。用80%v/v丙酮提取后,用分光光度计测定叶绿素含量。用Sunderland方法提取的叶绿素浓度,用Arnon(1949)公式计算。
(四)培养细胞系的02交换的测定
在25℃下,把0.11g组织(鲜重)悬浮在lml50mM磷酸缓冲液(pH=7.8)中,用一个氧电极测量O2交换。把细胞悬浮在5mM碳酸氢盐溶液中,用来自一个聚光灯并通过10cm的水层过滤的大约在100000lx的强光来测定光合作用的O2释放。
实例(Yasuda等,1980):
用茄科的三个种,颠茄、蔓陀罗、天仙子。取再分化或无菌生长的幼苗的叶子碎片,接种在培养皿中的无糖的Linsmaier-Skoog琼脂培养基上。激素由5μM或10μM NAA和0.05μM,0.5μM或5μM BA组成。培养皿放在透明的20L的玻璃小室中,从愈伤组织的诱导开始,通入含有1%CO2的混合气体,气体的流速为1L/min,用3000-50001x光强的荧光灯连续照光。容器内部的温度在27-29℃范围内。愈伤组织形成后,继代培养保持在与光自养相同条件中。
在上述自养的条件下,培养约2个星期后,接种的叶子小块开始肿大。在所有的天仙子和蔓陀罗的每一小块的边缘开始出现绿色的愈伤组织,但组织的其它部分开始变白和死亡。取其中最深的细胞在光自养的条件下继代培养(图11-5)。颠茄的培养体中,没有看到诱导出愈伤组织,但是,这些小块保持膨胀。颠茄叶子的有些小块形成了根。
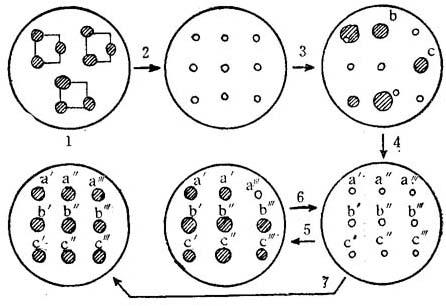
图11-5 选择光自养细胞程序
(1)在光自养和光混合营养的条件下诱导愈伤组织(2)把愈伤组织切成小块(3,5,7)愈伤组织的小块进行光自养培养(4,6)选择生长良好的绿色细胞株,然后切成小块(8)在没有糖的情况下生长良好的光自养细胞群的确立。重复(5)和(6)步,直到生长良好均匀的光自养细胞系产生和增殖。斜线的数目表示绿色程度。
天仙子和蔓陀罗光自养的生长,叶绿素的含量,光合作用O2释放的资料总结于表11-12。蔓陀罗细胞的叶绿素含量比天仙子细胞的高得多,但光自养培养的天仙子细胞的鲜重增长比光自养培养的蔓陀罗细胞增加得快。天仙子细胞的光合作用活性也比蔓陀罗要高,而且天仙子细胞(以叶绿素计算)的光合作用活性比再生的天仙子幼苗要高。
表11-12 天仙子和蔓陀罗培养物的光合作用特性

把培养的天仙子的细胞群分成小块,每一块都进行光自养培养,各块天仙子样品的光合作用活性和光自养生长的关系表示于图11-6,在天仙子细胞的光合作用活性和光自养生长之间有明显的相关性,但是在光自养生长和天仙子细胞的叶绿素含量之间没有相关性。

图11-6 天仙子细胞的光合作用活性和光自养生长之间的关系
每次培养用1-2g细胞植板,培养三周后收获。各个数值都是1-6个重复的平均值。
【参考文献】:
〔1〕Chaleff,R.S.1981 Genetics of higher plants.Application of cell culture.Cambridge Univ.Press,Cambridge.
〔2〕Handro,W.1981 Mutagenesis and in vitro selection.In:Plant Tissue Culture.Methods and Applications in Agriculture(T.A.Thorpe,ed.)pp.155-180.Academic Press,New York.
〔3〕Maliga,P.1980 Isolation,characterization and utilization of mutant cell lines in higher plants.In:International Review of Cytology,Suppl.11A,Perspectives in Plant Cell and Tissue Cuiture(I.K.Vasil,ed.)pp.225-251,Academic Press,New York.
〔4〕Sala,F.,Parisi,B.,Cella,R.,and Ciferri,O.(eds.)1980 Plant Cell Cultures:Results and Perspectives,pp.107-187.Elsevier/NorthHoland Biomedical Press,Amsterdam.
〔5〕Chu,I.1982 The use of tissue culture for brceding of herbicide tolerant varieties.In:Potentials of Cell and Tissue Culture Techniques in the Improvement of Cereals.International Rice Research Institute,Philippines, and The Chinese Academy of Science.
〔6〕Mer edith,C.P.and Carlson,P.S.1982 Herbicide resistance in plant cell culture.In:Herbicide Resistance(H.LeBaron and J.Gressel,eds.)pp.275-291.John Wiley and Sons,New York.
〔7〕Dix,P.J.1980 Environmental Stress resistance,Selection and plant cell cultures.In:Plant Cell Culttires:Results and Perspectives(F.Sala,B.Parisi,R.Cella,and O.Ciferri,eds.)pp.183-186.Elsevier/north-Holland Biomedical Press,Amsterdam,New York,and Oxford.
〔8〕Tal,M.,Heiken,H.,and Dehan,K.1978 Salt tolerance in the wild relatives of the Cultivated tomato,Z.Pflanzenphysiol.86:231-240.
〔9〕Levitt,J.1980 Responses of Plants to Environmental Stress,2nd ed.Acade mic Press,New York.
〔10〕Yamada,Y.,Sato,F.,and Hagimori,M.1979 Photoauto trophism in green cultured cells.In:Frontiers of Plant Tissue Culture(T.A.Thorp e.ed.)pp.453-462.IAPTC.Calgary.
〔11〕Yasuda,T.,Hashimoto,T.,Sato,F.,and Yamada,Y.1980.An efficient method of selecting photoautotrophic cell from cultured heterogeneous cell.Plant Cell Physiol.21:929-932.