平衡常数
出处:按学科分类—数理科学和化学 东北大学出版社《无机物热力学数据手册》第4页(2227字)
1.标准平衡常数
对反应(12),当达到化学平衡时,

式中Kθ为标准平衡常数(也可写成K。或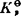 )。在标准状态规定之后,Kθ是温度的函数.是一个无量纲量。vi为反应式中组元Bi的计量系数,产物为正,反应物为负。ai为组元Bi的活度,这里应为平衡值。对稳定的纯固体和纯液体,ai=1;对气体,当压力不太大,可按理想气体处理时,活度即为pi/pθ,pθ为标准压力,等于101325Pa,如不能按理想气体处理,要用逸度代替分压;对溶液(包括液态溶液和固溶体)中一般溶质,ai=fici/cθ,其中ci为溶质Bi的浓度,采用什么浓度单位要视标准状态而定;cθ为标准浓度,其值为1,单位与c相同;fi为Bi的活度系数。对溶剂,ai=γixi,其中xi为溶剂的摩尔分数;γi为溶剂的活度系数。活度和活度系数的有关计算请参阅第五、六节。
)。在标准状态规定之后,Kθ是温度的函数.是一个无量纲量。vi为反应式中组元Bi的计量系数,产物为正,反应物为负。ai为组元Bi的活度,这里应为平衡值。对稳定的纯固体和纯液体,ai=1;对气体,当压力不太大,可按理想气体处理时,活度即为pi/pθ,pθ为标准压力,等于101325Pa,如不能按理想气体处理,要用逸度代替分压;对溶液(包括液态溶液和固溶体)中一般溶质,ai=fici/cθ,其中ci为溶质Bi的浓度,采用什么浓度单位要视标准状态而定;cθ为标准浓度,其值为1,单位与c相同;fi为Bi的活度系数。对溶剂,ai=γixi,其中xi为溶剂的摩尔分数;γi为溶剂的活度系数。活度和活度系数的有关计算请参阅第五、六节。
Kθ与反应标准自由能变化的关系为:
△Gθ=-RTlnKθ (30)
式中R为气体常数,8.314J·K-1·mol-1
△Gθ和Kθ对应物质所采用的标准状态应当相同。从本书查出有关数据,按式(26)或(28)求得△Gθ,即可按式(30)算出Kθ。有溶液参加反应时△Gθ的计算方法见第六节。
2.平衡常数的其它形式
压力平衡常数Kp对气体反应(12),各反应物平衡分压之间的关系为:

pi的单位为帕斯卡Pa。压力平衡常数Kp是温度的函数,它是有量纲的(当∑vi=0时例外,因为单位已互相消去了)。当气体可按理想气体处理时,Kp与Kθ的关系为:

当压力以大气压(atm)为单位时,由于标准状态为1atm,所以Kp与Kθ数值相等。另外,对于多相反应,包括有溶液参加的反应,如果固、液相的组元以活度代入,并且压力用atm为单位,略去Kp的量纲,则Kp与Kθ相同。现在还有许多文献仍采用这种表示方法。也就是说,在此条件下,式(30)的Kθ可写为Kp。
浓度平衡常数 对气体反应(12),各反应物平衡浓度之间的关系为

ci的单位为mol·dm-3,Kc为浓度平衡常数,是温度的函数,是有量纲的(当∑vi=0时例外)。Kc与Kp的关系为

对溶液中溶质的反应,有Kc,Km之分。Km中的浓度为质量摩尔浓度mol·(kg-1溶剂)。Km常用于电解质水溶液。
摩尔分数平衡常数Kx Kx为

xi为Bi的摩尔分数。Kx为温度和压力的函数,是无量纲的。对气体反应,它与Kp的关系为: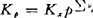 (36)
(36)
由于直接从热力学数据算出的平衡常数是Kθ(文献上也常写成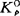 ,Kp,K。或K),所以经常应用。Kc(Km)用在稀溶液,由于忽略了活度系数,它只能近似地看作常数。对金属熔体,浓度c常用“%”,对水溶液常用体积摩尔浓度mol·dm-3。Kx则只在特殊情况下才使用(参阅第六节)。
,Kp,K。或K),所以经常应用。Kc(Km)用在稀溶液,由于忽略了活度系数,它只能近似地看作常数。对金属熔体,浓度c常用“%”,对水溶液常用体积摩尔浓度mol·dm-3。Kx则只在特殊情况下才使用(参阅第六节)。
〔计算实例〕 求反应
C石墨+CO2(g)=2CO(g)
1000K时的△GO和Kθ。
首先由表2-1查得1000K时,

另一计算法是利用表2-3△Gθ与T的关系式。查得
2C石墨+O2=2CO  =-228800-171.54T
=-228800-171.54T
C石墨+O2=CO2 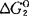 =-395350-0.54T
=-395350-0.54T
两式相减,可得
C石墨+CO2=2CO △Gθ=166570-171.0T
以1000K代入得△Gθ(1000K)=-4430J·mol-1

〔计算实例〕 求上例的反应在1000K达平衡时,标准压力下和10kPa压力下的比值%CO/%CO2。由上例,已知此反应1000K时Kθ=1.70

因ac=1,故

式中p为总压,即p=pco+pco2
(1)以p=101.325kPa,pθ=101.325kPa,Kθ=1.70代入,解得%CO=12.22,%CO2=87.78,%CO/%CO2=0.139
(2)以p=10kPa,pθ=101.325kPa,Kθ=1.70代入,解得%CO=33.77,%CO2=66.23,%CO/%CO2=0.510