(1)花生仁、壳、植株和土壤中残留量检测方法
出处:按学科分类—农业科学 中国农业出版社《农药残留量实用检测方法手册第3卷》第307页(5762字)
山西省农业科学院植物保护研究所 秦曙 王霞 朱九生 周华 乔雄梧
一、代森锰锌残留量检测
样本中代森锰锌在加热的密闭顶空瓶中,遇HCl/SnCl2时,消化反应生成的CS2气体被瓶中的正己烷吸收,形成CS2的正己烷溶液,气相色谱法(FPD-S)测定有机相中CS2的量,代表代森锰锌的残留量。
1.主要仪器及设备
气相色谱仪 火焰光度检测器(FPD-S)
电热恒温水浴锅
分散器
高速万能粉碎机
50mL顶空瓶 具聚四氟乙烯/硅橡胶密封垫(20mm)和密封铝盖(20mm)
2.主要试剂
正己烷(HPLC级)、氯化亚锡(SnClB2·2H2O)、浓盐酸(含量36%~38%)氯化亚锡/5mol/L盐酸溶液每100mL5m0l/L盐酸中含2g氯化亚锡(SnCl2 2H2O)代森锰锌标准品
3.检测步骤
3.1 提取
3.1.1 土壤
称取5.0g混匀的土壤于50mL顶空瓶中,加5mL水、0.05g抗坏血酸、10mL氯化亚锡/5mol/L盐酸溶液和5.0mL正己烷,使用压盖器迅速将瓶口用聚四氟乙烯/硅橡胶密封垫(20mm)和密封铝盖(20mm)密封。放入85℃水浴中反应2h,每隔15min摇1次。冷却至室温,吸取上层有机相,测定。
3.1.2 花生仁
称取5.0g匀浆的花生仁于50mL顶空瓶中,加入0.05g抗坏血酸、10mL氯化亚锡/5mol/L盐酸溶液、5.0mL正己烷,以下操作同土壤。
3.1.3 花生壳
称取5.0g粉碎的花生壳于50mL顶空瓶中,加入0.05g抗坏血酸、10mL水、20mL氯化亚锡/5mol/L盐酸溶液、5.0mL正己烷,以下操作同土壤。
3.1.4 花生秧
称取10.0g剪碎混匀的花生秧,于50mL顶空瓶中,加入0.05g抗坏血酸、20mL氯化亚锡/5mol/L盐酸溶液、10.0mL正己烷,以下操作同土壤。
3.2 气相色谱法测定
检测器 FPD-S
色谱柱 3mmi.d.×1.5m玻璃柱,10%SE-30/Chromosorb W AW DMCS60~100目
检测温度 柱温60℃;进样口150℃;检测器150℃
载气 高纯氮,50mL/min
燃烧气 空气1.3kg/cm2,氢气0.9kg/cm2
进样量 2μL
保留时间 0.60min
4.结果计算
外标(峰面积)-标准曲线法测定
供试花生仁的平均含油率为50%,在酸解的过程中花生油进入正己烷相,使体积增加,在做添加回收和样本检测时,正己烷相的体积校正为7.5mL。
5.灵敏度、准确度和精确度
最小检出量 8×10-11g(CS2)。
最低检测浓度 代森锰锌0.1mg/kg,二硫化碳0.03mg/kg。
回收率 准确称取代森锰锌标准品5.0mg左右,用100mL纯净水分数次将其洗入高颈烧杯中,然后放在分散器上匀浆2min,在液体不停旋转下,快速吸取定量溶液至对照样本中。
用对照土壤、花生秧、花生仁和花生壳样本进行添加回收率试验。每一浓度反应瓶分为两组:一组为样本处理,另一组为空白处理,空白处理只加入代森锰锌标准溶液,不加花生或土壤样本。以空白处理测得的CS2比率计算添加回收率。
花生秧、花生仁、花生壳及土壤中添加代森锰锌0.1~2.0mg/kg时,平均回收率分别为80.8%~110.0%、81.0%~89.7%、71.9%~97.9%和73.4%~99.6%,见表2-20-1。
相对标准偏差 3.3%~22.0%,见表2-20-1。
表2-20-1 土壤、花生秧、花生壳和花生仁中代森锰锌添加回收率及相对标准偏差实验结果

6.花生和土壤中代森锰锌(二硫化碳)气相色谱测定谱图
见图2-20-1。



图2-20-1 花生和土壤中代森锰锌(二硫化碳)气相色谱测定谱图
二、乙撑硫脲(ETU)残留量检测
样本用甲醇提取,氧化铝柱层析净化,液相色谱法(UV)测定。
1.主要仪器及设备
液相色谱仪 紫外检测器(UV)
旋转蒸发器
循环水多用真空泵
分散器
高速万能粉碎机
层析柱 Φ10mm×10cm
实验室玻璃仪器,用前需经硅烷化处理
2.主要试剂
甲醇(优级纯)、乙醇(重蒸)、丙酮(重蒸)、二氯甲烷(重蒸)、氯化钠、氨水、纯净水
5%二甲基二氯硅烷正己烷溶液
1%和25%乙二醇丙酮溶液
淋洗液 乙醇/二氯甲烷(5∶95,V/V)
中性氧化铝 100~200目,用前130℃烘烤4h,干燥器中保存
助滤剂Celite545
上试102酸洗白色担体40~60目,pH6~8
乙撑硫脲(ETU)标准品
3.检测步骤
3.1 提取
3.1.1 土壤
称取20.0g土壤于250mL三角瓶中,加10mL水,用氨水调节至pH11~12。加入2.5g氯化钠、2.5g助滤剂和40mL甲醇,超声振荡5min,减压抽滤。用30mL甲醇分数次冲洗样本瓶和布氏漏斗。调整pH至7~9,定容至100mL,混匀。取该溶液50mL于圆底烧瓶中,加入3滴1%乙二醇丙酮溶液,用旋转蒸发器(60℃)浓缩至约5mL。加入3g担体,迅速振荡,直至所有团块全部散开,待柱层析净化。
3.1.2 花生仁、花生壳
称取10.0g匀浆后的花生仁,加10mL水(花生壳粉碎后称取10.0g,加50mL水),用氨水调节至pH11~12。加入2.5g氯化钠、2.5g助滤剂和40mL甲醇,超声提取5min,减压抽滤。用30mL甲醇分数次冲洗样本瓶和布氏漏斗,调整至pH7~9,定容至100mL,混匀。取50mL该溶液(花生壳样本取该溶液20mL)于150mL分液漏斗中,分别用30mL、20mL、20mL石油醚洗涤3次,弃去石油醚相。水相放入圆底烧瓶中,加入3滴1%乙二醇丙酮溶液,用旋转蒸发器(60℃)浓缩至约3mL。加入3g担体,迅速振荡,直至所有团块全部散开,待柱层析净化。
3.1.3 花生秧
称取5.0g剪碎混匀的花生秧,加10mL水,用氨水调节至pH11~12。加入2.0g氯化钠、1.5g助滤剂和40mL甲醇,超声提取5min,减压抽滤。用40mL甲醇分数次冲洗样本瓶,超声处理后抽滤。用HCl调整滤液至pH7~9,定容至100mL,混匀。取该溶液20mL于150mL分液漏斗中,分别用30mL、20mL、20mL石油醚洗涤3次,弃取石油醚相。水相放入圆底烧瓶中,加入3滴1%乙二醇丙酮溶液,用旋转蒸发器(60℃)浓缩至约3mL。加入3g担体,迅速振荡,直至所有团块全部散开,待柱层析净化。
3.2 净化
3.2.1 土壤
称取5g中性氧化铝,湿法装柱,用30mL二氯甲烷/乙醇(95∶5,V/V)预淋。在上述提取浓缩液中加入10mL淋洗液,摇匀后转入柱中,弃去淋出液。用50mL淋洗液分3次漂洗烧瓶并加入柱中用于洗脱。收集洗脱液,加入3滴25%的乙二醇丙酮溶液,减压浓缩(40℃)至约2mL,氮气吹干,用甲醇/水(3∶7,V/V)定容至2.5mL,待测。
3.2.2 花生仁、花生壳和花生秧
称取5g中性氧化铝,湿法装入层析柱中,分别用20mL二氯甲烷/乙醇(95∶5,V/V)和10mL二氯甲烷预淋。在上述提取浓缩液中加入10mL二氯甲烷,摇匀后转入柱中,再用20mL二氯甲烷、10mL淋洗液漂洗烧瓶并加入柱中,弃去淋出液。用50mL淋洗液分3次漂洗烧瓶并加入柱中用于洗脱。收集洗脱液,加入3滴25%的乙二醇丙酮溶液,减压浓缩(40℃)至约2mL,氮气吹干,用甲醇/水(3∶7,V/V)定容至2.5mL,待测。
3.3 液相色谱法测定
检测器 UV
波长 254nm
色谱柱 Kromasil C18,4.6mm×250mm×5μm
流动相 甲醇/水(30∶70,V/V)
流速 0.4mL/min
进样量 20μL
保留时间 7.02min
4.结果计算
外标(峰面积)-标准曲线法定量
5.灵敏度、准确度和精确度
最小检出量 1.0×10-9g。
最低检测浓度 0.05mg/kg。
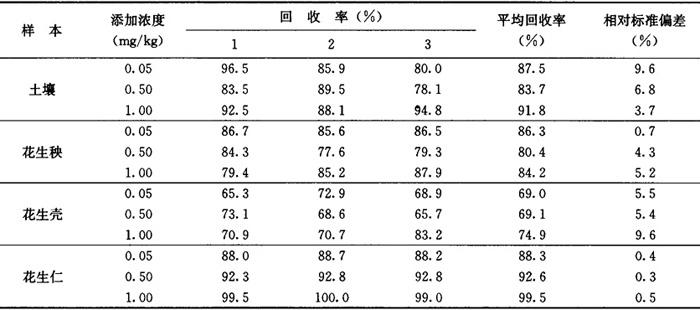
回收率 花生秧、花生仁、花生壳及土壤中添加ETU0.05~1.00mg/kg时,平均回收率分别为80.4%~86.3%、88.3%~99.5%、69.0%~74.9%和83.7%~91.8%。见表2-20-2。
相对标准偏差 0.3%~9.6%,见表2-20-2。
表2-20-2 土壤、花生秧、花生壳和花生仁中ETU添加回收率及相对标准偏差实验结果
6.花生和土壤中ETU液相色谱测定谱图
见图2-20-2。


图2-20-2