蛋白质
出处:按学科分类—农业科学 中国轻工业出版社《肉类工业手册》第59页(7177字)
肉中蛋白质的含量仅次于水的含量,大部分存在于动物的肌肉组织中。肌肉中的蛋白质占鲜重的20%左右,占肉中固形物的80%。肌肉中的蛋白质按照其所存在于肌肉组织上位置的不同,可分为肌原纤维蛋白、肌浆蛋白、基质蛋白和颗粒蛋白四类。
(一)肌原纤维蛋白
肌原纤维是骨骼肌的收缩单位,由丝状的蛋白质胶原组成。这些细丝平行排列成束,直接参加肌肉的收缩过程,当去掉这些蛋白质后,肌纤维的形状和组织结构会完全遭到破坏,因此又称结构蛋白或不溶性蛋白质。通常利用离子强度0.5以上的高浓度盐溶液抽出,但被抽出后的蛋白质可溶于低离子强度的盐溶液中,属于这类蛋白质的有肌球蛋白、肌动蛋白、原肌球蛋白、肌原蛋白、肌动蛋白素和M-蛋白等。
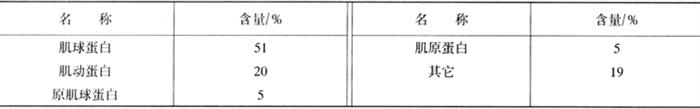
肌原纤维蛋白质占肌肉蛋白质总量的40%~60%,肌原纤维蛋白质的含量随肌肉活动的增加而增加。肌原纤维中的蛋白质与肉的重要品质特性(如嫩度)密切相关。
表1-3-5 肌原纤维蛋白质的种类与含量
1.肌球蛋白
肌球蛋白是肌肉中含量最高和最重要的蛋白质,约占肌肉总蛋白质的三分之一,占肌原纤维蛋白质的50%~55%。肌球蛋白是粗丝的主要成分,构成肌节的A带。肌球蛋白的相对分子质量为50万~60万。肌球蛋白在离子强度为0.2以上的盐溶液中溶解,在0.2以下则呈不稳定的悬浮状态,可以用0.3mol/L KCl或0.1mol/L磷酸盐缓冲液抽提出来。肌球蛋白具有流动双折射现象,从肌肉中除去肌球蛋白后,则肌纤维的暗带消失,可以证明肌球蛋白是肌原纤维中的暗带组成成分。
肌球蛋白的特性之一是具有ATP酶的活性,Mg2+对此酶起抑制作用,Ca2+可以将其激活。ATP在肌球蛋白ATP酶作用下分解生成ADP及磷酸时,释放能量,可供肌肉收缩时能量的利用。肌球蛋白的另一个特征是能与肌动蛋白结合,生成肌动球蛋白。肌球蛋白的ATP酶活性和肌球蛋白与肌动蛋白的结合特性密切相关,当分解ATP时,肌球蛋白可能先和ATP结合,结合位点是在酶的活性中心(-SH)处。如无抑制剂的存在,结合后的ATP即迅速分解。但肌球蛋白与肌动蛋白的结合位点可能也是在酶的活性中心处。因而,ATP与肌动蛋白可竞争与肌球蛋白的酶活性中心结合,故较大量的ATP可占有此中心而破坏肌球蛋白与肌动蛋白的结合。
肌球蛋白是关系到肉在加工中的嫩度变化和某些其它性质的重要成分,肌球蛋白对热很不稳定,受热而发生变性。变性的肌球蛋白失去了ATP酶活性,溶解性降低。焦磷酸对此热变性有某种程度的抑制作用。将肌球蛋白以胰蛋白酶处理时,可以生成两种亚基,分别称为重酶解肌球蛋白和轻酶解肌球蛋白,重酶解肌球蛋白为水溶性,可保持ATP酶的活性和与肌动蛋白结合的能力,轻酶解肌球蛋白不溶于水,对盐的溶解性与肌球蛋白相同,但具有双折光线。重酶解肌球蛋白用胰蛋白酶进一步水解,可以裂解为两个肽段,一个保持有ATP活性及与肌动蛋白结合的能力,另一个则无此能力。
肌球蛋白是粗丝的构成成分,它由两条很长的肽链相互盘旋构成,这两条肽链称为重链,相对分子质量为194000,两条肽链各形成一盘旋的头部,在尾部有数条轻链。因此,肌球蛋白的形状很像“豆芽”,全长为140nm,其中头部为20nm,尾部为120nm;头部的直径为5nm,尾部直径为2nm。大约需400个肌球蛋白分子构成一条粗丝。在构成粗丝时,肌球蛋白的尾部相互重叠,而头部伸出在外,并做很有规则的排列。
肌球蛋白的性质:肌球蛋白不溶于水或微溶于水,具球蛋白性质,在中性盐溶液中可溶解,等电点为5.4,在50~55℃发生凝固,易形成黏性凝胶,在饱和的NaCl或(NH4)2SO4溶液中可盐析沉淀。肌球蛋白的头部有ATP酶活性,可以分解ATP,并可与肌动蛋白结合,生成肌动球蛋白,与肌肉的收缩直接有关。
2.肌动蛋白
肌动蛋白约占肌原纤维蛋白的20%,是构成细丝的主要成分。肌动蛋白以球状的肌动蛋白(G-肌球蛋白)和纤维状肌动蛋白(F-肌动蛋白)的形式存在。单体的G-肌动蛋白相对分子质量约为47000,为球形的蛋白质分子结构,直径为5.5nm。当G型肌动蛋白在有磷酸盐和少量ATP存在的时候,即可形成相互连接的纤维状结构,需300~400个G-肌动蛋白形成一个纤维状结构。两条纤维状结构的肌动蛋白相互扭合成的聚合物称为F-肌动蛋白,与原肌球蛋白、肌钙蛋白、α-辅肌动蛋白和β-辅肌动蛋白等结合构成了肌原纤维结构中的细丝,或称肌动蛋白丝。两条F-肌动蛋白每经13个G-肌动蛋白单位而扭转一周形成螺旋结构。
肌动蛋白的性质属于白蛋白类,它还能溶于水及稀的盐溶液中,在半饱和的(NH4)2SO4溶液中可盐析沉淀,等电点为4.7,F-肌动蛋白在有KI和ATP存在时又会解离成G-肌动蛋白。
3.肌动球蛋白
肌动球蛋白是肌动蛋白与肌球蛋白的复合物,肌动球蛋白根据制备手段的不同可以分为两种,一种是在新鲜的磨碎肌肉中加入5~6倍的Webber-Eedsall溶液(0.6mol/L KCl,0.01mol/L Na2CO3,0.06mol/L NaHCO3)抽提24h,离心后取上清液,稀释后使其沉淀,再将其溶解并再沉淀,如此反复3~4次精制而制得的肌动球蛋白,这种肌球蛋白称为天然肌动球蛋白,另一种是预先抽提出肌球蛋白和F-肌动蛋白,然后混合制得的肌动球蛋白,该肌动球蛋白称为合成肌动球蛋白。
肌动球蛋白的黏度很高,具有明显的流动双折射现象,由于其聚合度不同,因而相对分子质量也不同。肌动蛋白与肌球蛋白的结合比例在1∶2.5至1∶4。肌动球蛋白也具有ATP酶活性,但与肌球蛋白不同的是Ca2+和Mg2+都能激活肌动球蛋白。高浓度的肌动球蛋白易形成凝胶。在高的离子强度下,如0.6mol/L的KCl溶液中,添加ATP则溶液的黏度降低,流动双折射也减弱,其原因是肌动球蛋白受ATP的作用分解成肌动球蛋白和肌球蛋白。添加焦磷酸盐也可看到同样的现象。将接近中性的肌动球蛋白溶液稀释到较低的离子强度如0.1mol/L KCl溶液中,则肌动球蛋白由于接近其等电点而形成絮状物,此时若添加少量的ATP,絮状物因收缩而形成凝胶沉淀,这样的沉淀现象称为超沉淀,此时如将KCl溶液提高,则超沉淀可以再次溶解;如在絮状物中添加多量的ATP,那么此絮状肌动球蛋白就发生溶解,这个反应称为清除反应。
4.原肌球蛋白
原肌球蛋白占肌原纤维蛋白的4%~5%,形状为棒状分子,长45nm,直径2nm。位于F肌动蛋白的双股螺旋结构的每一沟槽内,构成细丝的支架。每1分子的原肌球蛋白结合7分子的肌动蛋白和1分子的肌钙蛋白。相对分子质量为65000~80000,在SDS聚丙烯酰胺(SDS-PAGE)电泳中,可分出两条带,其相对分子质量分别为34000和36000。原肌球蛋白在8M脲中进行层析时可以分离出α和β两条链。在白肌纤维中α∶β=4∶1,在红肌纤维中α∶β=1∶1。
5.肌钙蛋白
肌钙蛋白占肌原纤维蛋白的5%~6%,肌钙蛋白对Ca2+有很高的敏感性,并能结合Ca2+。每一个蛋白分子具有4个钙的结合位点,沿着细丝以38.5nm的周期结合在原肌球蛋白分子上,相对分子质量为69000~81000。肌原蛋白有三个亚基,即钙结合亚基(相对分子质量为18000~21000,是Ca2+的结合部位)、抑制亚基(相对分子质量为20500~24000,能高度抑制肌球蛋白中ATP酶的活性,从而阻止肌动蛋白与肌球蛋白结合)和原肌球蛋白结合亚基(相对分子质量为30500~37000,能结合原肌球蛋白,起连接作用)。
(二)肌浆蛋白
肌浆是浸透于肌原纤维内外的液体,它含有各种有机物与无机物,一般占肉中蛋白质含量的20%~30%。通常将磨碎的肌肉压榨便可挤出肌浆。它包括肌溶蛋白、肌红蛋白、肌球蛋白-X和肌粒中的蛋白质等。这些蛋白质易溶于水或低离子强度的中性盐溶液,是肉中最易提取的蛋白质。又因其提取液的黏度很低,故常称为肌肉的可溶性蛋白质。这些蛋白质不是肌纤维的结构成分,将其提取后,各种肉的特征、形态及性质没有明显的改变。这些蛋白质也不直接参与肌肉收缩,其主要功能是参与肌纤维中的物质代谢。
1.肌溶蛋白
肌溶蛋白属清蛋白类的单纯蛋白质,存在于肌原纤维间。易溶于水,把肉用水浸透可以溶出。很不稳定,易发生变性沉淀,其沉淀部分称为肌溶蛋白B,约占肌浆蛋白质的3%,相对分子质量为80000~90000,等电点为6.3,凝固温度为52℃,加饱和的(NH4)2SO4或醋酸可被析出。把可溶性的不沉淀部分称为肌溶蛋白A,也称肌白蛋白,约占肌浆蛋白的1%,相对分子质量为150000,易溶于水和中性盐溶液,等电点为3.3,具有酶的性质。
2.肌红蛋白
肌红蛋白是一种复合性的色素蛋白质,由一分子的珠蛋白和一个亚铁血色素结合而成,为肌肉呈现红色的主要成分,相对分子质量为34000,等电点为6.78,含量占0.2%~2%。肌红蛋白有多种衍生物,如呈鲜红色的氧合肌红蛋白、呈褐色的高铁肌红蛋白、呈鲜亮红色的NO肌红蛋白等。这些衍生物与肉及其制品的色泽有直接的关系。肌红蛋白的含量,因动物的种类、年龄、肌肉的部位不同而不同。凡是动物生前活动较频繁的部位,肌红蛋白含量就高,肉色较深。
3.肌浆酶
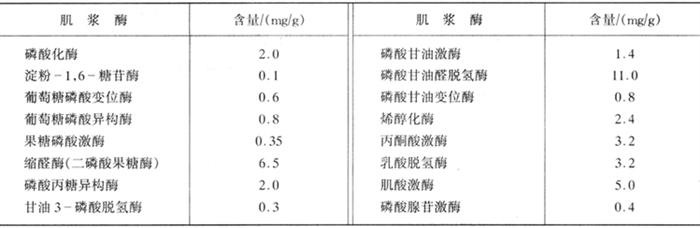
肌浆中除上述可溶性蛋白质及少量肌球蛋白-X外,还存在大量可溶性肌浆酶,其中解糖酶占2/3以上。主要的肌浆酶见表1-3-6。从表中看出在肌浆中缩醛酶和肌酸激酶及磷酸甘油醛脱氢酶含量较多。大多数酶定位于肌原纤维之间,有研究证明缩醛酶和丙酮酸激酶对肌动蛋白、原肌球蛋白、肌原蛋白有很高的亲和性。红肌纤维中解糖酶含量比白纤维少,只有其1/5~1/10。而红肌纤维中一些可溶性蛋白的相对含量,以肌红蛋白、肌酸激酶和乳酸脱氢酶含量最高。
表1-3-6 肌肉中肌浆酶蛋白的含量
4.肌粒蛋白
肌粒包括肌核、线粒体和微粒体等,存在于肌浆中。肌粒蛋白主要为三羧基循环酶及脂肪氧化酶系统,这些蛋白质定位于线粒体中,在离子强度0.2以上的盐溶液中溶解,在离子强度0.2以下则呈不稳定的悬浮液。另外一种重要的蛋白质是ATP酶,是合成ATP的部位,定位于线粒体的内膜上。
(三)基质蛋白
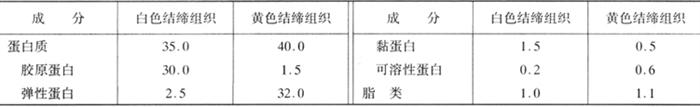
基质蛋白为结缔组织蛋白质,是构成肌内膜、肌束膜、肌外膜和腱的主要成分,包括胶原蛋白、弹性蛋白、网状蛋白及黏蛋白等,存在于结缔组织的纤维及基质中。
表1-3-7 结缔组织蛋白质的含量 单位:%(质量分数)
1.胶原蛋白
胶原蛋白在结缔组织中含量特别丰富,尤其是胶原蛋白在白色结缔组织中含量较多,如在肌腱等胶原纤维组织中胶原蛋白约占总固体量的85%。胶原纤维广泛分布于皮、骨、腱、动脉壁以及哺乳动物肌肉组织的肌内膜、肌束膜和肌外膜中,是构成胶原纤维的主要成分。胶原蛋白是机体中最丰富的简单蛋白质,相当于机体总蛋白质的20%~25%。胶原蛋白中含有大量的甘氨酸,约占总氨基酸残基的30%,脯氨酸和羟脯氨酸亦较多,后两者为胶原蛋白中特有的氨基酸,一般蛋白质大多不含此两种氨基酸或含量甚微,因此,通常用测定羟脯氨酸含量的多少来确定肌肉结缔组织的含量,并作为衡量肌肉质量的一个指标。色氨酸、酪氨酸及蛋氨酸等必需氨基酸含量甚少,故此种蛋白质是不完全蛋白质。胶原蛋白的氨基酸组成可随动物年龄而变化,如在鸡骨的胶原蛋白中发现,随着鸡的成长,其中赖氨酸的含量增加,而羟脯氨酸的含量逐渐减少。在哺乳动物中,绝大多数种类的胶原蛋白的氨基酸组成很相似。
胶原蛋白是由胶原纤维蛋白原聚合而成的,胶原纤维蛋白原是一种纤维状蛋白分子,由三条螺旋状的肽链组成,三条肽链再以螺旋状互相拧在一起,犹如三股拧起来的绳一样,每个胶原纤维蛋白原分子长280nm,它的直径为5nm,相对分子质量为300000。胶原纤维蛋白原很有规则地聚合成胶原蛋白,每一原胶原分子依次头尾相接,呈直线排列。原胶原分子间的联结除共价键(氢键)外,还有各类不同含量的共价键间的交叉链,交联的程度随着年龄的增长而增加,交联程度越大,性质越稳定,这种交联的程度直接影响到肉的嫩度。
胶原蛋白性质稳定,质地坚韧,具有很强的延伸力,不溶于一般溶剂,但在酸或碱的环境中则可膨胀。它不易被胰蛋白酶、糜蛋白酶所消化,可被胃蛋白酶及细菌所产生的胶原蛋白酶所消化。此外,胶原蛋白与水一起加热至62~63℃时,发生不可逆收缩,于80℃水中长时间加热,则形成明胶,此明胶易于消化。明胶为含有的胶原蛋白丰富的皮、骨和腱等经部分水解后得到的高分子天然多肽的高聚物,干燥状态下很稳定,潮湿状态下易被细菌分解。明胶不溶于冷水,但加水后则缓慢吸水,膨胀软化;溶于热水,溶液冷却后即凝成胶块,因此,它可以可逆地进行溶胶与凝胶的变化。熔点为25~30℃,明胶的凝胶弹性随原料、制造条件、pH和电解质的变化而变化。明胶的等电点为4.7,在等电点时明胶溶液黏度最小,亦最容易硬化。
2.弹性蛋白
弹性蛋白在很多组织中与胶原蛋白共存,它是构成黄色的弹性纤维的蛋白质,但在皮、腱、肌膜和脂肪等组织中含量很少,而在韧带与血管(特别是大动脉壁)中含量最多,约占其弹性纤维总固体重量的25%。弹性蛋白的弹性较强,但强度不及胶原蛋白,其抗断力仅为胶原蛋白的1/10。弹性蛋白在化学上很稳定,不溶于水,即使在水中煮沸后,亦不能分解成明胶,对酸、碱、盐都很稳定,以SDS聚丙烯酰胺凝胶电泳测定的相对分子质量为70000。它是由弹性蛋白质与赖氨酸共价交联形成的不溶性弹性硬蛋白,这种弹性蛋白不被结晶的胰蛋白酶、胰凝乳蛋白酶和胃蛋白酶所作用,但可被无花果蛋白酶、木瓜蛋白酶、菠萝蛋白酶和胰弹性蛋白酶水解。
弹性蛋白的氨基酸组成中,亦含有30%的甘氨酸,但羟脯氨酸含量很少,从营养上考虑,弹性蛋白也是不完全蛋白质。不同来源的弹性蛋白,其氨基酸组成大体恒定,但也可有一定的差别。例如赖氨酸的含量在牛的大动脉中比韧带中多,而在耳朵的弹性软骨中则更高。
3.网状蛋白
在肌肉中,网状蛋白为构成肌内膜的主要蛋白,含有约4%的结合糖类和10%的结合脂肪酸,其氨基酸组成与胶原蛋白相似,用胶原蛋白酶水解,可产生与胶原蛋白同样的肽类。因此有人认为它的蛋白质部分与胶原蛋白相同或类似。网状蛋白对酸、碱比较稳定。
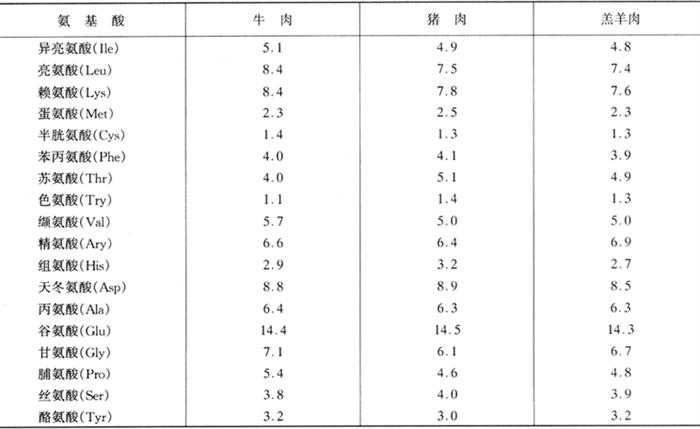
从营养价值角度讲,肉类食品中蛋白质的含量不仅丰富,而且蛋白质的营养价值高,肉类蛋白提供的氨基酸模式与人类生存与生长的需要相吻合,是人类膳食中重要的优质蛋白来源。各种肉类食品中蛋白质和氨基酸的含量见表1-3-8、表1-3-9和表1-3-10。
表1-3-8 鲜肉和熟肉的组成与能量含量 单位:%(质量分数)
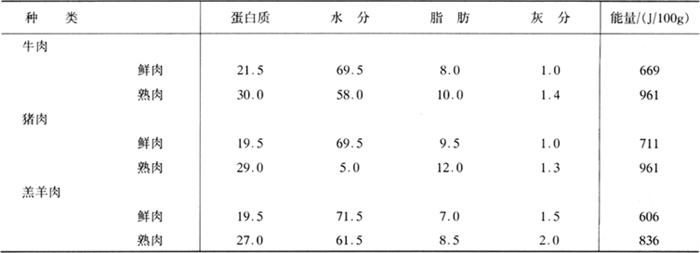
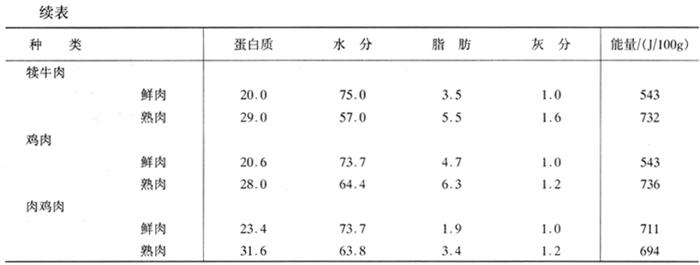
表1-3-9 各种脏器熟制后蛋白质和脂肪的含量 单位:%(质量分数)
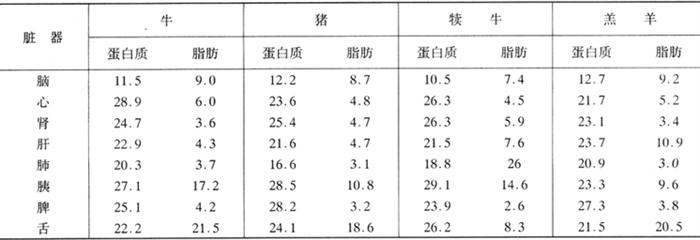
表1-3-10 鲜肉中的氨基酸含量(粗蛋白) 单位:%(质量分数)