5′-肌苷酸二钠
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第170页(5168字)
化学名:5′-肌苷酸二钠(Sodium 5′-inosinate)
结构式:
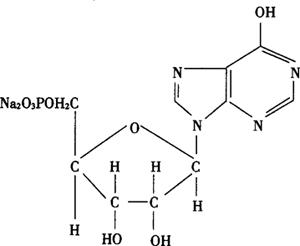
分子式:C10H11N4Na2O8P·XH2O
相对分子质量(无水):392.17
一、5′-肌苷酸二钠的鉴别
1.试剂和溶液
1.1 硫酸铵。
1.2 异丙醇。
1.3 展开溶液 饱和硫酸铵:异丙醇∶水=79∶2∶19(体积比)。
1.4 滤纸 新华层析滤纸Ⅲ号。
2.仪器
2.1 紫外分析仪(波长254nm)。
2.2 微量注射器。
2.3 紫外分光光度计(配10mm石英比色杯)。
3.操作步骤
3.1 试样液的制备 称取样品1.0g(准确至0.0001g),用水溶解并稀释至100mL,取10.0mL,用新华Ⅲ号滤纸点样,于展开溶剂中展开30cm,取出晾干或烘干,在紫外分析仪中划出紫外吸收斑点,剪于Φ10mm×100mm的小试管中,4.0mL加0.01mol/LHCl溶液;将试管放入80℃恒温水浴,保温30min,冷却为IMP的试样液。
3.2 最大吸收波长的测定 将试样倒入1cm光程的石英比色杯中,在240~265nm范围内,以0.01mol/LHCl作空白,用紫外分光光度计测定其最大吸收波长。
3.3 结果的处理 最大吸收波长在(250±2)nm内,即为IMP。
二、5′-肌苷酸含量的测定
1.操作步骤
将IMP试样液倒入1cm光程石英比色杯中,以0.01mol/LHCl溶液作空白,用紫外分光光度计测定IMP的最大紫外吸光度。
2.分析结果的表述

式中 400——稀释倍数
527——IMP的相对分子质量
11.7×103——IMP的摩尔吸光系数
0.1——样品定容体积,L
m1——样品质量,g
A1——IMP在波长250nm处的吸光度
3.允许差
同一样品两次测定值之差,不得超过1%。
三、食品中5′-肌苷酸二钠的测定
食品中5′-肌苷酸二钠(别名:肌苷-5′-磷酸二钠)用高压液相色谱定量。在畜禽肉、鱼肉中都存在着天然的肌苷酸。因此,当样品是含有上述原料的食品时,测定结果应是样品中的5′-肌苷酸和所添加的总和。
1.试剂和溶液
1.1 腺苷磷酸二钠。
1.2 乙二胺四乙酸二钠 特级。
1.3 高氯酸 60%,特级。
1.4 活性炭[1] 市售活性炭用下述方法精制,用标准筛筛取105~250μm粒径的活性炭200g,加入1.5L(19→200)盐酸溶液搅拌30min,过滤。再用1000mL水及1.5L氨-乙醇溶液,按上述操作重复2次,加1000mL(0.372→1000)乙二胺四乙酸二钠,搅拌30min,过滤。最后用水反复洗至中性,风干保存。
1.5 活性炭柱(见图8-1) 在玻璃柱下端塞少许脱脂棉,注入水至柱高的一半左右,再将300mg活性炭混悬于10倍量的水中,注入柱中,活性炭沉降后,在上端轻轻压上少量脱脂棉,使水流出后,再用(1→100)盐酸溶液约30mL流过,即可使用。
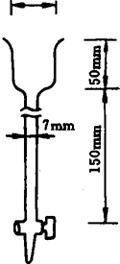
图8-1 活性炭柱
1.6 酶(5′-核苷酸酶) 向牛精液1mL中加入预先将5mg硫酸精朊溶于1mL水的溶液,0~5℃离心分离,取上清液,于50~60℃加热20min,冷却后,离心分离(9000r/min),离心20min,该上清液即为酶的标准品,可冷冻保存。
1.7 酶溶液 向1.0~1.25单位酶(5′-核苷酸酶)(按照I.U.B酶委员会单位,1单位∶基质腺苷-5′-二磷酸钠,在pH7.537℃1min能生成1μmol无机磷的酶量)和123.2mg硫酸镁中加5mL0.5mol/LTris缓冲液(pH7.5),使之溶解。
1.8 乙酸铵 特级。
1.9 乙酸 1.5mol/LCH3COONH4缓冲液(pH3.4):准确取90g冰乙酸,加水溶解至1000mL,作为A液。再称取115.5g乙酸铵溶于水,准确至1000mL,为B液。将B液加入到1000mLA液中,调节pH到3.4,用0.45μm滤膜过滤器过滤。
1.10 0.5mol/LTris缓冲液(pH7.5) 将60.6g三羟甲基氨基甲烷溶于约500mL水中,用盐酸调节pH至7.5,补加水至1000mL。
1.11 Ttris缓冲液 硫酸镁混合液:123.2mg硫酸镁加5mL0.5mol/LTris缓冲液(pH7.5)溶解。
1.12 Tris(羟甲基)氨基甲烷 特级品。
1.13 硫酸(鱼)精朊。
1.14 硫酸镁 特级。
2.仪器
高压液相色谱仪。
3.测定方法
3.1 样品溶液的制备。
3.1.1 水溶性食品:一般准确取相当1~5mg5′-肌苷酸钠的样品20g以下,加水约90mL,用(19→200)盐酸溶液调节pH约为2后[2],补加水准确至100mL,即为样品溶液。
3.1.2 水不溶性食品:一般准确取相当1~5mg5′-肌苷酸钠的样品20g以下,加入30mL(2→25)高氯酸溶液,捣碎匀浆,用(2→25)高氯酸溶液定量的洗至离心管中,离心分离(在冷冻条件下,以10000r/min离心分离10min),分取上清液,再向残渣中加30mL(2→25)高氯酸溶液,同样操作重复2次,合并全部上清液,补加(2→25)高氯酸溶液,准确至100mL,即为样品溶液[3][4]。
3.2 测定液的制备 准确取样品溶液VmL[5],通过预先准备好的活性炭柱,然后用约20mL水冲洗,直至洗液pH接近中性,接着用20mL(1→10)氨水[6],以0.5mL/min流速洗脱,收集洗脱液。在水浴上蒸发至干,再准确加10mL水,混匀溶解,即为活性炭处理液。
分别准确取活性炭处理液1mL,加入2个试管中,其中一管加0.2mL酶液,另一管加0.2mLtris缓冲液·硫酸镁混合液,于37℃恒温水浴中保持60min,然后冷却至常温,即为测定液A、B。
3.3 标准液的制备 准确称取5′-肌苷酸钠250mg,加水溶解至100mL,再取此液2mL,补加水至100mL,即为标准原液(冰箱中可保存1周)(此液1mL含5′-肌苷酸钠50μg)。分别准确取标准原液1mL,加入两个试管中,按3.2与活性炭处理液同样操作,即得标准液As、Bs。
3.4 测定方法。
3.4.1 测定条件:高压液相色谱仪,按下述条件进行测定。
填充剂:多孔性离子交换树脂
柱:内径4.6mm,长25cm
柱温:60℃
洗脱剂:乙酸、CH3COONH4缓冲液(1.5mol/L,pH3.4)
流速和压力:1.5ml/min,约0.7MPa
测定波长:254nm
3.4.2 定量:分别准确取5μL标准液As、Bs及测定液A、B,注入液相色谱仪中,从测得的谱图中求出各自峰高,按式(8-2)计算样品中5′-肌苷酸钠含量(mg/100g)。
4.分析结果的表述

式中 m1——标准5′-肌苷酸钠用量,mg
m——取样量,g
V——样品溶液用量,mL
As——标准液As测得的5′-肌苷酸峰高
Bs——标准液Bs测得的5′-肌苷酸峰高
A——测定液A测得的5′-肌苷酸峰高
B——测定液B测得的5′-肌苷酸峰高
注:[1]活性炭的精制活化,不是使吸附能力增加而是降低,使吸附的5′-肌苷酸能定量地洗脱、溶出。
[2]5′-肌苷酸在pH2~4时,易被活性炭吸附。
[3]含油脂多的食品在离心分离时,油脂在离心管的上层,可用吸管把清液取出,不使油脂混入清液中,必要时用硅藻土过滤。
[4]为了从水不溶性食品中抽取5′-肌苷酸钠,也可用热水。
[5]一般用10mL,但是,为了使5′-肌苷酸含量为0.25~0.5mg,可适当增减样品溶液量。
[6]用(1→20)氨水可以将5′-肌苷酸从活性炭上洗下来,也可以用氨-乙醇混合液、氨-正丁醇-乙醇混合液〔氨水∶水∶正丁醇∶乙醇(体积比)(7∶43∶5∶45)〕洗脱,但氨水、醇系比氨水易将活性炭吸附的食品中褐色物与5′-肌苷酸一同洗下来。
[7]测定液中的5′-肌苷酸钠浓度。
