燃烧的学说和理论
出处:按学科分类—政治、法律 中国商业出版社《最新单位消防工作实务全书第一卷》第155页(5301字)
时至今日,燃烧在生产、军事和生活领域里是被应用得最为广泛的一种氧化反应。然而,人们对燃烧现象的实质,在漫长的时期里缺乏正确的认识和解释,虽然在学术界曾有过许多有关燃烧的学说和理论,但却没有一种能对燃烧的实质给予科学合理的解释!直到20世纪初,才由苏联科学家谢苗诺夫创建了燃烧的链式反应理论,它得到了世界各国化学界的公认,是现代用来解释燃烧实质的基本理论。
众所周知,火和电的发明是促进人类物质文明飞速发展的两座里程碑,而火比电的发明和利用要早得多,可是比较起来,电的科学早已发展到了相当的高度,今天在电工学和无线电电子学的范围内,几乎已没有人们所不能解释的了。但在关于火的科学方面却不然,人们经常在最简单的现象面前束手无策,对于内燃机以及锅炉的设计,往往较之最复杂的电动机或无线电设备的设计更感到困难,这说明对燃燃科学的研究是何等的薄弱。长期以来,在不少有关火的问题上,人们往往缺乏可加以利用的合理的科学知识。由于目前世界各国经常发生严重的火灾和爆炸事故,因此,有关燃烧和爆炸的科学研究受到普遍的重视。
(一)燃烧素学说
18世纪以前,欧洲盛行燃烧素学说(亦称燃素学说),对当时化学界的影响很大。燃素学说认为,某种物体之所以能燃烧是因为其中含有一种燃烧索,燃烧时,燃烧素就从物体内逸出。例如,蜡烛的燃烧,当燃烧素都跑出来以后,蜡烛也就熄灭了。燃素学说在解释什么是燃烧素时,认为火是由无数细小活跃的微粒构成的物质实体,由这种火微粒构成的火的元素就是燃烧素,物质如果不含有燃烧素则不能燃烧。
燃素学说始终没有说明燃烧素是什么成分组成的物质。显然,这种学说的建立不是以科学根据为基础,而是凭空臆造出一个“燃烧素”来。所以,燃烧素学说实际上是唯心主义的、不科学的。
由于燃素学说在当时的化学界非常盛行,影响很大,许多着名的化学家都是燃素学说的崇拜者和忠实信徒,这就大大地阻碍了人们对燃烧实质的研究。例如,英国化学家普里斯特利虽然在实验室里得到了氧,但因他是燃素学说的一个忠实的信徒,所以没有认识到这一发现对研究燃烧的重要性。当时有的科学家早已认识到燃烧和空气是分不开的,认为“空气常滋养火焰,而火焰则不断地消耗空气。燃烧部分如无新空气补入,其中将成为真空”;还认为“火焰发生时,必引起空气之流动,此种空气是以维持或滋长火焰,而火焰则时时将四周空气消耗。如无新空气流入,则燃烧处必致成为真空。更进而言之,世间如无空气,不仅火不能发生,即使万物亦无生长之可能”。
在燃素学说之后,还有不少学说的理论。例如,四元素学说认为,燃烧是“火、水、空气、土”这四种元素的作用。四元素学说解释木材的燃烧现象时认为,木材燃烧时所产生的明显火焰为“火素”,蒸发散发的潮气(湿气)为“水素”,上升的烟为“空气素”,剩余的灰为“土素”。
汞硫盐学说认为,火焰的发生是因为物体中含有硫质,气体的逸出为汞素,剩余之灰为所含的盐质,等等。
(二)燃烧的氧学说
法国化学家拉瓦锡在普里斯特利发现氧气的基础上,进行研究和做了大量实验,于1777年提出了燃烧的氧学说,认为燃烧是可燃物与氧的化合反应,同时放出光和热。拉瓦锡指出,物质里根本不存在一种所谓燃烧素的成分。
燃烧氧学说的建立是对燃烧科学的一大贡献,它宣告了燃烧素学说的破灭。
(三)燃烧的分子碰撞理论
根据化学上的定义,强烈的氧化反应并有热和光同时发生者称为燃烧。热和光只是说明燃烧过程中发生的物理现象,那么燃烧的这种氧化反应是怎样发生的呢?亦即燃烧的实质是什么呢?
近代用链式反应理论来解释燃烧的实质,而在这个理论之前,曾有燃烧的分子碰撞理论、活化能理论和过氧化物理论等。
燃烧的分子碰撞理论认为,燃烧的氧化反应是由于可燃物和助燃物两种气体分子的互相碰撞而引起的。众所周知,气体的分子都是处于急速运动的状态中,并且不断地彼此互相碰撞,当两个分子发生碰撞时,则有可能发生化学反应。但是,用这种理论解释燃烧的氧化反应时,其可能性却非常微小。例如,氢与氯的混合物在常温下避光贮存于容器中,它们的分子每秒钟彼此碰撞达10亿次之多,但觉察不到有任何反应;可是,若把这种混合物置于日光照射下,虽不改变其温度和压力,氢与氯两者却可以极快的速度进行反应,生成氯化氢,并呈显出光和热的燃烧现象,甚至能引起爆炸。由此可见,气态下物质的反应速度,并不能仅以分子碰撞次数的多少来加以解释。这是因为在互相碰撞的分子间会产生一般的排斥力,只有在它们的动能极高时,才能在分子的组成部分产生显着的振动,引起键能减弱,使分子各部位的重排有可能,亦即有可能引向化学反应。这种动能,按其大小而言,接近于键的破坏能,因而至少是2.1~41.8kJ/mol。这就意味着一切反应必须在极高温度下才能发生,因为41.8kJ/mol的活化能相当于1200~1400℃的反应温度。假如同意这种观点,那么燃烧与氧化反应应该是特别困难的,因为双键O=O的破坏能是49kJ/mol,而C-H键的破坏能为33.5~41.8kJ/mol。但是,实验证明最简单的碳氢化合物的燃烧、氧化反应在300℃左右就可以进行了。上面的推证排斥了下面这样一种见解,即可燃物质的燃烧是它们的分子与氧分子直接起作用而生成最终的氧化产物。
(四)活化能理论
为了使可燃物和助燃物两种气体分子间产生氧化反应,仅仅依靠两种分子发生碰撞还不够,正如前面所说的,在互相碰撞的分子间会产生一般的排斥力。在通常的条件下,这些分子没有足够的能量来发生氧化反应,只有当一定数量的分子获得足够的能量以后,才能在碰撞时引起分子的组成部分产生显着的振动,使分子中的原子或原子群之间的结合减弱,分子各部分的重排才有可能,亦即有可能引向化学反应。这些具有足够能量的、在互相碰撞时会发生化学反应的分子,称为活性分子。活性分子所具有的能量要比普通分子平均能量高出一定值。使普通分子变为活性分子所必需的能量,称为活化能。
图2-3-1中的纵坐标表示所研究系统的分子能量,横坐标表示反应过程,A点表示系统开始时的动力状态。当这个系统接受转入活性状态B所必需的能量E1后,将引起反应,并且这个系统将在减弱能量E2的情况下进入结束状态C。能量差

图2-3-1 反应中的分子活化能
E1-E2=-Q(E2大于E1)
为反应的热效应。
活化能理论指出了可燃物和助燃物两种气体分子发生氧化反应的可能性及其条件。
(五)过氧化物理论
过氧化物理论认为,分子在各种能量(热能、辐射能、电能、化学反应能)的作用下可以被活化。比如在燃烧反应中,首先是氧分子(O=O)在热能作用下活化,被活化的氧分子的双键之一断开,形成过氧基-O-O-,这种基能加合于被氧化物质的分子上面而形成过氧化物:

在过氧化物的成分中有过氧基-O-O-,这种基中的氧原子较之游离氧分子中的〓更不稳定。因此,过氧化物是强烈的氧化剂,不仅能氧化形成过氧化物的物质而且也能氧化用分子氧很难氧化的其他物质B:
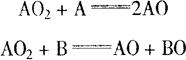
例如,氢与氧的燃烧反应,通常直接表达为
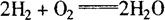
按照过氧化物理论则认为先是氢和氧生成过氧化氢,而后才是过氧化氢再与氢反应生成H2O。其反应式如下:

有机过氧化物通常可看做过氧化氢H-O-O-H的衍生物,在其中,有一个或两个氢原子被烃基所取代而成为H-O-O-R或R-O-O-R。所以,过氧化物是可燃物质被氧化时的最初产物,它们是不稳定的化合物,能够在受热、撞击、摩擦等情况下分解而产生自由基和原子,从而又促使新的可燃物质的氧化。
过氧化物理论在一定程度上解释了为何物质在气态下有被氧化的可能性。它假定氧分子只进行单键的破坏,这比双键的破坏要容易一些。因为破坏1mol氧的单键只需要29.3~33kJ的能量。但是若考虑到C-H键也必须破坏,氧分子也必须加合于碳氢化合物之上而形成过氧化物,则氧化过程还是很困难的。因此,巴赫又提出了另一种说法,即易氧化的可燃物质具有足以破坏氧中单键所需的“自由能”,所以不是可燃物质本身而是它的自由基被氧化。这种观点就是近代关于氧化作用的链式反应理论的基础。
(六)链式反应理论
链式反应理论是由苏联科学家谢苗诺夫提出的。他认为物质的燃烧经历以下过程:可燃物质或助燃物质先吸收能量而离解为游离基,与其他分子相互作用形成一系列连锁反应,将燃烧热释放出来。这可以列举氯和氢的作用来说明。氯在光的作用下被活化成活性分子,于是构成一连串的反应: 链的引发
链的引发
 链的传递
链的传递

依此类推 链的中断
链的中断
上列反应式表明,最初的游离基(或称活性中心、作用中心等)是在某种能源的作用下生成的,产生游离基的能源可以是受热分解或光照、氧化、还原、催化和射线照射等。游离基由于具有比普通分子平均动能更多的活化能,所以其活动能力非常强,在一般条件下是不稳定的,容易与其他物质分子进行反应而生成新的游离基,或者自行结合成稳定的分子。因此,利用某种能源设法使反应物产生少量的活性中心——游离基时,这些最初的游离基即可引起连锁反应,因而使燃烧得以持续进行,直至反应物全部反应完毕。在连锁反应中,如果作用中心消失,就会使连锁反应中断,而使反应减弱直至燃烧停止。
总的来说,连锁反应机理大致可分为三段:1.链引发,即游离基生成,使链反应开始;2.链传递,游离基作用于其他参与反应的化合物,产生新的游离基;3.链终止,即游离基的消耗,使连锁反应终止。造成游离基消耗的原因是多方面的,如游离基相互碰撞生成分子,与掺入混合物中的杂质起副反应,与非活性的同类分子或惰性分子互相碰撞而将能量分散,撞击器壁而被吸附等。
综上所述,燃烧是一种复杂的物理化学反应。光和热是燃烧过程中发生的物理现象,游离基的连锁反应则说明了燃烧反应的化学实质。按照链式反应理论,燃烧不是两个气态分子之间直接起作用,而是它们的分裂物——游离基这种中间产物进行的链式反应。
在链式反应中,存在着链的增长速度和链的中断速度。当链的增长速度等于或大于链的中断速度时,燃烧才能产生和持续;当链的中断速度大于链的增长速度时,燃烧则不会发生或正在进行的燃烧会停止。
链式反应有分支连锁反应和不分支连锁反应两种。上述氯和氢的反应是不分支连锁反应的典型,即活化一个氯分子可出现两个氯的游离基,也就是两个连锁反应的活性中心,每一个氧游离基都进行自己的连锁反应,而且每次反应只引出一个新的游离基。
氢和氧的反应则属于分支连锁反应:


由于反应式Ⅲ和Ⅳ各生成两个活化中心,因此,如图2-3-2所示这些反应中连锁会分支。

图2-3-2 分支连锁反应