卤水处理主要方法及流程
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第992页(8875字)
(一)空气吹出法除H2S
天然卤水中,尤其是黑卤中,常含有硫化氢(H2S),在制盐过程中与铁作用,生成硫化铁,污染产品,腐蚀设备,必须从卤水中除去。
1.空气吹出法 鼓空气入卤水中,将卤水中硫化氢带出。
2.塔炉脱气法 在塔炉上部喷入卤水,卤水受热升温,使溶解的硫化氢逸出并随烟道气一起排出。
(二)支条架法
四川省自贡、五通桥以及蓬莱、射洪等地均曾采用支条架浓缩卤水,并除去硫化氢和部分二水硫酸钙。在日光充足而多风的地方使用,尤为经济。其布置一般为东西向,以利日照。支条架系木、竹结构,高7~9m,长10~15m,架的两面铺以细竹枝或细树枝,底为水泥平盘(见图3-4-1)。架顶安装直径125~150mm的盐水管,管侧有小孔,淡卤用水泵送至盐水管,经小孔沿竹枝分散下流,落入平盘,流回卤水贮池,再用泵将卤水送至架顶盐水管喷洒,如此循环进行,以蒸发水分,脱除部分硫化氢;同时可将低价铁氧化为高价铁,以便加入石灰水后生成氢氧化铁沉淀。为卤水浓缩至14~15°Bé时,CaSO4·2H2O从卤水中结晶析出,附结于枝梢。
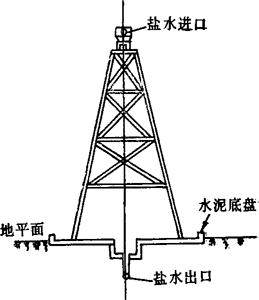
图3-4-1 支条架示意图
(三)化学法(除H2S)
1.三氯化铁——石灰法 用于处理含H2S50mg/L以下的黄、黑卤水。其主要反应为:
H2S+2FeCl3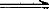 2FeCl2+2HCl+S↓
2FeCl2+2HCl+S↓
2FeCl2+2H2S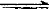 2FeS+4HCl
2FeS+4HCl
综合反应式:3H2S+2FeCl3=2FeS+6HCl+S↓
加入石灰,中和生成的HCl,并除去剩于Fe3+:
HCl+Ca(OH)2=CaCl2+2H2O
2Fe3++3Ca(OH)2=2Fe(OH)2↓+3Ca2+
其流程如图3-4-2。
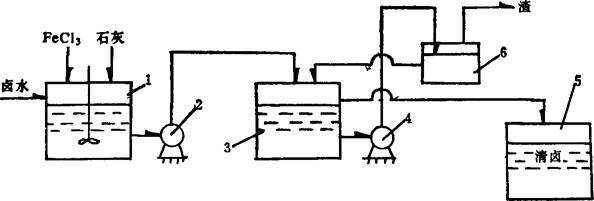
图3-4-2 FeCl3-石灰法流程图
1-反应桶 2、4-泵 3-澄清桶 5-清卤桶 6-假底过滤器
2.氯气氧化法 通氯气于黄、黑卤中,使H2S被氧化成单体硫而除去,主要反应为:
H2S+C12=2HCl+S↓
加入石灰,中和HCl,除去卤水中Fe3+、Mg2+及过剩C12。
3Ca(OH)2+2Fe3+===2Fe(OH)3↓+3Ca2+
Ca(OH)2+Mg2+===Mg(OH)2↓+Ca2+
2Cl2+2Ca(OH)2===Ca(C1O)2+CaCl2+2H2O
2HCl+Ca(OH)2===CaCl2+2H2O
为了防止Ca(C1O)2在受热时分解出原子氧,造成设备的腐蚀,可加入硫代硫酸钠将其还原。
其流程如图3-4-3。
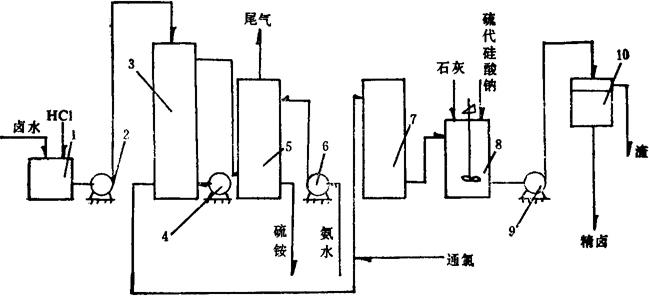
图3-4-3 氯气氧化法流程图
1-酸化槽 2、6、9-泵 3-吹出管 4-鼓风机 5-吸收塔 7-氧化器 8-中和槽 10一过滤器
3.硫酸亚铁沉淀法 将绿矾(FeSO4·7H2O)加入含硫化氢的黑卤中,生成硫化亚铁沉淀,从而除去卤水中硫化氢。其反应如下:
H2S+FeSO4·7H2O→FeS↓+H2SO4+7H2O
(四)石灰(或烧碱)——芒硝法
本法广泛用于有钡黄卤的处理,加石灰(或烧碱)除去铁和镁,加芒硝除钡。其反应为:
FeCl3+3NaOH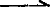 Fe(OH)3↓+3NaCl
Fe(OH)3↓+3NaCl
MgCl2+2NaOH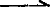 Mg(OH)2↓+2NaCl
Mg(OH)2↓+2NaCl
或:CaO+H2O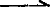 Ca(OH)2
Ca(OH)2
3Ca(OH)2+2FeCl3 2Fe(OH)3↓+3CaCl2
2Fe(OH)3↓+3CaCl2
Ca(OH)2+MgCl2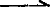 Mg(OH)2↓+CaCl2
Mg(OH)2↓+CaCl2
BaCl2+NaSO4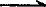 BaSO4↓+2NaCl
BaSO4↓+2NaCl
反应后均生成极难溶于水的沉淀Mg(OH)2、Fe(OH)3、BaSO4,从卤水中分离除去。
1.工艺流程 为了利用化工资源和保护环境卫生,可用两步法生产铁红和沉淀硫酸钡。其流程如图3-4-4。
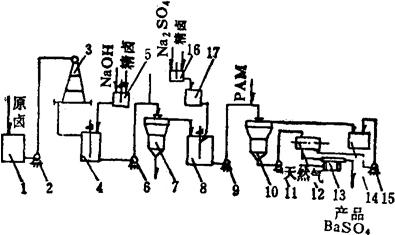
图3-4-4 烧碱-芒硝法处理有钡黄卤流程图
1-原卤贮池 2-原卤泵 3-支条架 4-一号反应桶 5-NaOH配制桶 6-一次卤泵 7-一次澄清桶 8-二号反应桶 9-混合料液泵 10-二次澄清桶 11-硫酸钡浆料泵 12-单盘翻斗过滤器 13-干燥锅 14-净化卤池 15-滤液泵 16-芒硝液配制桶 17-芒硝液贮桶
2.操作控制指标
(1)生产铁红时,加入NaOH量为理论量的110%,NaOH配制浓度为20%。加入速度视容器和搅拌状态而定。若用空气压缩机鼓入空气搅拌,则NaOH加入速度为卤水加入时间的2/3。空气搅拌时间为2h。
(2)加芒硝除钡,是在常温下进行的。当卤水中氯化钡含量为3~4g/L时,芒硝加入量为理论量的118~125%,即可保证不出钡盐。从制盐角度而言,芒硝加入量越少越好,既可降低原料消耗,又可减少带入卤水的SO4=,降低卤水中CaSO4含量,减少蒸发过程中的结垢。实际生产中,以控制反应后卤水中SO4=含量小于0.3g/L为宜。
(3)为了保证BaSO4质量,芒硝必需溶解澄清,最好通入氯气脱色,浓度为75~90g/L。一般用精卤作溶剂,以减少水分带入系统。芒硝与卤水同时按比例加入,越均匀越好,生产上一般用混合桶或分散板达到这一目的。
(4)反应过程中产生的沉淀必需从卤水中分离出去。生产上常用沉降池或澄清桶分离液固相。助凝剂一般采用聚丙烯酰胺(简称PAM)。泥浆则用离心机或真空过滤机过滤。
(5)聚丙烯酰胺是一种高分子絮凝剂,分子量一般在250~300万之间,中性,为无毒透明胶体(其单体丙烯酰胺有毒),溶于水,但溶解速度很慢,需要齿轮泵或在其他强烈搅拌下才能溶化。我国出产的聚丙烯酰胺纯度为7%(其余为水)。
使用时将聚丙烯酰胺加水,配制成0.5~0.1%水溶液,然后由澄清桶进料口徐徐加入反应后的卤水中。聚丙烯酰胺在卤水中浓度为2ppm(过多过少都会影响澄清效果)。加入聚丙烯酰胺后可提高澄清速度1~5倍;若加入BaSO4作晶种,其沉降速度会更快。详见表3-4-11、3-4-12和图3-4-5、3-4-6。
表3-4-11 聚丙烯酰胺用量与沉降关系

表3-4-12 加入BaSO4晶种后聚丙烯酰胺用量与沉降关系

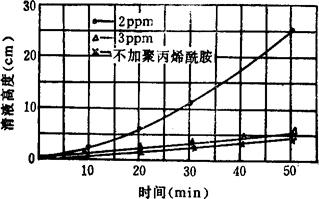
图3-4-5 聚丙烯酰胺浓度与澄清关系曲线
(卤水浓度17°Bé,温度9℃)
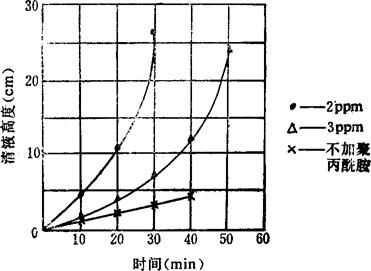
图3-4-6 加入BaSO4晶种后聚丙烯酰胺用量与澄清关系曲线
(卤水浓度17°Bé,温度9℃)
整个澄清过程可在常温下进行。
(五)石灰——石膏除钡法
1.基本原理 石膏与氯化钡反应生成难溶于水的硫酸钡沉淀。
BaCl2+CaSO4→BaSO4↓+CaCl2
为了使BaSO4沉淀完全,需增大SO42-浓度。实践证明,当净化卤中SO42-含量控制在0.2~0.3g/L时,可保证不出钡盐,并可大大减少CaSO4锅垢的生成。
这里采用锻烧石膏比常温石膏为好,用量少,除钡效率也高。
3.工艺流程(图3-4-7)
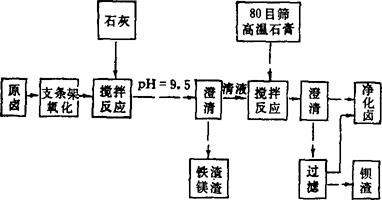
图3-4-7 石膏除钡流程图
高温石膏用量及SO42-残留量见图3-4-8。
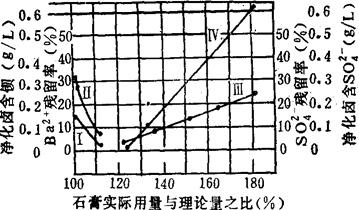
图3-4-8 高温干燥石膏用量与Ba2+、SO42-的关系
曲线Ⅰ表示高温干燥石膏用量与Ba2+残留率的关系。曲线Ⅱ表示高温干燥石膏用量与去钡卤水中Ba2+单位含量(g/L)的关系。曲线Ⅲ表示高温干燥石膏用量与SO42-残留率的关系。曲线Ⅳ表示高温干燥石膏用量与去钡卤水中SO42-单位含量(g/L)的关系。
3.处理效果 根据测定数据,高温石膏除钡可使卤水符合真空制盐的要求,其原料消耗量和卤水成分变化见表3-4-13、3-4-14。
表3-4-13 石膏和卤水消耗量(为理论量的123%)

表3-4-14 卤水净化前后成分变化(单位:g/L)

注:(1)石膏加入量为理论量的123%。
(2)投入的石膏中除含有CaSO4外,还含有其他化合物,故某些成分稍有增加。
(3)搅拌速度230r/min,搅拌时间30min。
(4)反应温度16.3℃。
此法虽可达到除钡之目的,但处理后的卤水中Ca2+含量大大增加,料液沸点上升,粘度增加,并加大母液排出量,增大热量损失,不利于制盐。
(六)黄、黑(岩)卤混合法
如当地既产黑卤或岩卤,又产有钡黄卤,一般采用黄、黑(岩)卤混合法。因为黑卤和石膏型岩卤中含有CaSO4,芒硝型岩卤中含大量Na2SO4,这两种物质均可和黄卤中的BaCl2作用生成BaSO4沉淀,使两种卤水均可得到精制,因而极为经济。其基本反应为:
BaCl2+CaSO4→BaSO4↓+CaCl2
BaCl2+Na2SO4→BaSO4↓+2NaCl
在混合槽中,黄卤、黑(岩)卤、石灰同时不断加入,搅拌反应1h,可达反应完全。经现场检验,SO42-含量小于0.3g/L,卤水中无钡显示,可视为合格。
(七)石灰-纯碱法
1.基本原理 有些卤水中含有Ca(HCO3)2、CaSO4、MgSO4、MgCl2等杂质,它们和石灰及纯碱反应,生成难溶性的沉淀,而从卤水中分离。
MgSO4+Ca(OH)2→Mg(OH)2↓+CaSO4
MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2
Ca(HCO3)2+Ca(OH)2→2CaCO3↓+H2O
CaSO4+Na2CO3→CaCO3↓+Na2SO4
CaCl+Na2CO3→CaCO3↓+2NaCl
若同时加入两种药剂,则反应按下列各式进行:
CaO+H2O→Ca(OH)2
Ca(OH)2+Na2CO3→CaCO3↓+NaOH
Ca(HCO3)+2NaOH→CaCO3↓+Na2CO3+H2O
MgSO4+2NaOH→Na2SO4+Mg(OH)2↓
CaSO4+Na2CO3→CaCO3↓+Na2SO4
实践证明,按照以上反应式计算,所得结果相同,与石灰、纯碱的加入次序无关。
2.工艺流程见图3-4-9。
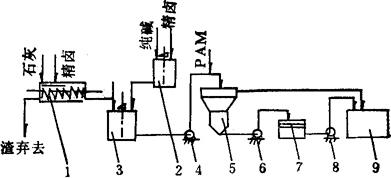
图3-4-9 石灰-纯碱法工艺流程图
1-石灰乳配制桶 2-纯碱液配制桶 3-反应桶(附搅拌) 4-料液泵 5-澄清桶 6-排泥泵 7-过滤池 8-滤液泵 9-净化卤池
3.生产效果 生产或试验证实,用此法精制卤水效果极佳,见表3-4-15及3-4-16°
表3-4-15 某厂卤水精制前后组成(单位:g/L)
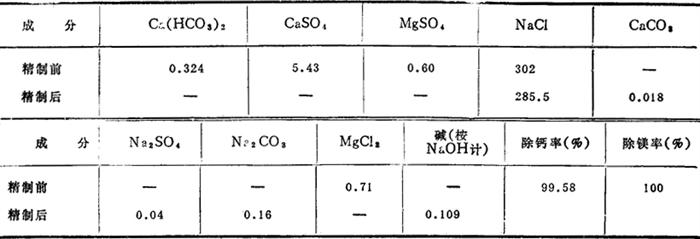
表3-4-16 某单位精制试验成分变化
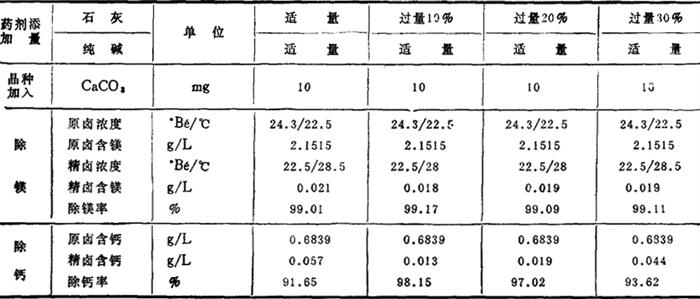
4.沉淀物的沉降速度 表3-4-17和图3-4-10为某厂用石灰-纯碱法精制卤水时对沉淀物沉降速度测定的数据。
表3-4-17 沉降速度测定
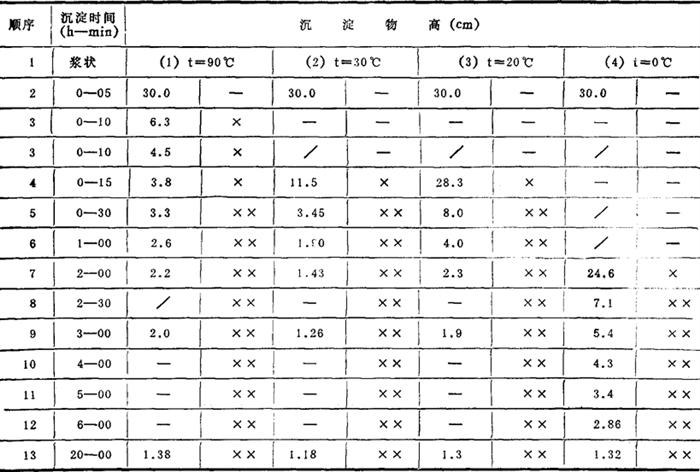
注:×——半透明;××——透明无悬浮物;-——浑浊;/——未计高度。
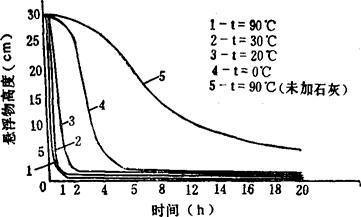
图3-4-10 不同温度下石灰-纯碱法沉淀物沉降速度曲线
由表3-4-17和图3-4-10可知,温度对沉降有一定关系。当温度由90℃降至0℃时,浑浊液的沉降速度并非随温度的降低而呈直线减少;而在20~30℃条件下,沉降速度十分令人满意。同样静置1h,90℃时清液高度为总高度的91.34%,30℃时清液高度为总高度的93.67%,20℃时,清液高度为总高度的86.7%。此种沉降速度完全满足连续生产的条件。
(八)石灰-芒硝-碳化法
1.基本原理 石灰和芒硝反应生成NaOH,NaOH与烟道气反应生成Na2CO3,Na2CO3再与Ca#作生成难溶物质CaCO3。反应分两步进行:
第一步;
MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2
CaCl2+Na2SO4→CaSO4+2NaCl
MgSO4+Ca(OH)2→Mg(OH)2↓+CaSO4
Ca(OH)2+Na2SO4→CaSO4+2NaOH
第二步:
2NaOH+CO2→Na2CO3+H2O
CaSO4+Na2CO3→CaCO3↓+Na2SO4
所得沉淀物是Mg(OH)2和CaCO3、CaSO4;溶液中是NaCl、Na2SO4。因此制盐母液可回头使用,利用其中芒硝。
2.芒硝的苛化 芒硝苛化生成NaOH是此法的基本反应,而影响其转化率的因素主要是芒硝的初始浓度和反应温度。
化学家纽曼·卡特怀特曾将Na2SO4初始浓度和NaOH产量的关系绘制成图,见图3-4-11;并根据实验列出芒硝浓度、温度对NaOH产量的关系,如表3-4-18。
表3-4-18 Na2SO4浓度、温度对NaOH产量的影响
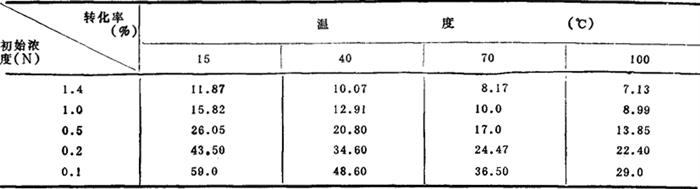
由图3-4-11和表3-4-18清楚地看出,当浓度一定、温度升高时,或温度一定芒硝浓度升高时,苛性钠产量均降低。但在适当的温度(15℃)和适当的芒硝浓度(0.1N)的条件下,转化率可接近60%,反应时间一般为4h。
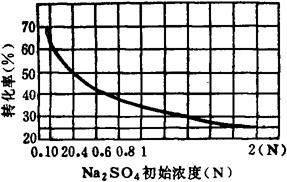
图3-4-11 Na2SO4初始浓度与NaOH产量关系
当芒硝型卤水中含NaCl 270g/L左右、含Na2SO4 30~40g/L、含CaSO4 1.5g/L时,氧化钙用量按理论量的50%配制。但生产中要考虑沉淀铁、镁所需的氧化钙。氧化钙太少,会使形成的OH-和CO32-不足以除去卤水中Ca2+、Mg2+;太多并不能增加OH浓度,因而Na2CO3生成量也不会增加,在NaCl存在情况下,芒硝转化率会降低。
用此法精制卤水的主要工艺参数及成分变化情况见表3-4-19和表3-4-20。
表3-4-19 石灰-芒硝-碳化法精制卤水工艺数据
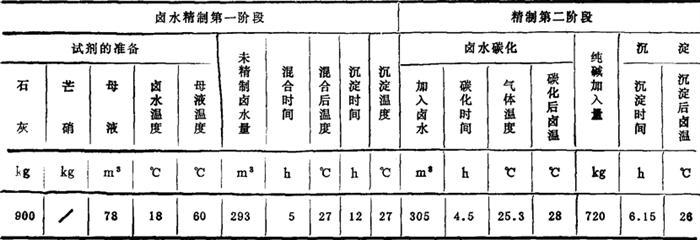
表3-4-20 石灰-芒硝-碳化法精制卤水分析数据
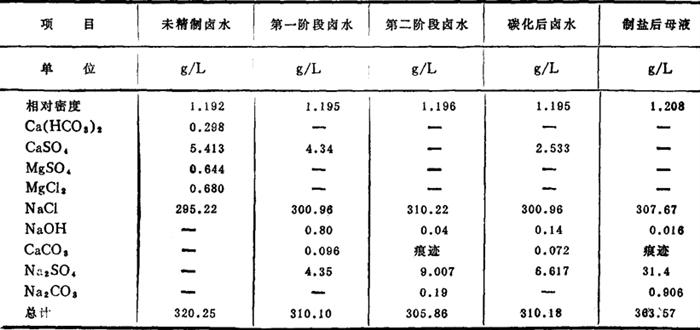
3.工艺流程
石灰-芒硝-碳化法综合工艺流程如图3-4-12。

图3-4-12 石灰-芒硝-碳化法工艺流程图
1-石灰-芒硝液配制桶(附搅拌) 2-药剂泵 3-一次反应桶(附搅拌) 4-一次反应泵 5-一次斜板澄清桶 6-碳化反应桶(附搅拌) 7-纯碱液配制桶 8-CO2鼓风机 9-碳化卤水泵 10-二次斜板澄清桶 11-精卤贮池 12-排渣泵 13-沉降过滤池 14-过滤液泵
通入CO2的浓度为10~15%,通气量以卤水pH值控制在8.2~9.0为宜。若pH值太低,生成的CaCO3沉淀将重新溶解,无法除去。
CaCO3+CO2→Ca(HCO3)2
(九)烧碱-纯碱-氯化钡法 适用于含Ca艹、Mg艹和SO4″的卤水,精制后卤水杂质甚少,可用以生产高质量的食用盐及工业用盐。其反应如下:
MgCl2+2NaOH→Mg(OH)2↓+2NaCl
FeCl3+3NaOH→Fe(OH)3↓+3NaCl
CaSO4+Na2CO3→Na2SO4+CaCO3↓
CaCl2+Na2CO3→2NaCl+CaCO3↓
Na2SO4+BaCl2→2NaCl+BaSO4↓
其工艺流程见图3-4-13。
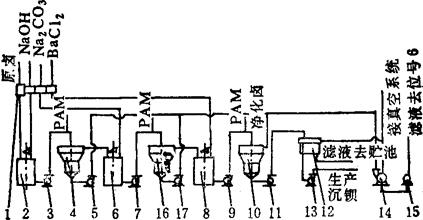
图3-4-13 烧碱-纯碱-氯化钡法工艺流程图
1-计量分配桶 2-第一反应桶 3-一次卤泵 4-一次澄清桶 5-排渣泵 6-碳酸钠反应桶 7-二次反应卤泵 8-氯化钡反应桶 9-三次反应卤泵 10-三次卤水澄清桶 11-硫酸钡泥泵 12-翻斗过滤器 13-二次滤液泵 14-真空过滤机 15-一次滤液泵 16-二次卤水澄清桶 17-CaCO3泥浆泵
(十)其他处理方法
1.钙芒硝法 在芒硝型卤水中,加入二水石膏,反应生成钙芒硝复盐沉淀,从而分离芒硝,净化卤水。其反应式为:
Na2SO4+CaSO4·2H2O→Na2SO4·CaCO2↓+2H2O
2.氯化钙法 在有大量氯化钙的地区,可用氯化钙处理芒硝含量高的卤水。其反应式为:
Na2SO4+CaCl2→CaSO4↓+2NaCl
氯化钙加入量为理论量的两倍,并加入二水石膏(CaSO4·2H2O)作晶种,搅拌2h,消除CaSO4的过饱和状态,可使卤水中硫酸钙含量降至5g/L,氯化钙含量7g/L,硫酸钠全部除去。
3.碳酸钡法 用碳酸钡与含硫酸钙的卤水反应,生成难溶性物质BaSO4和CaCO3,使卤水净化。其反应式为;
BaCO3+CaSO4→BaSO4↓+CaCO3↓