中和试验
出处:按学科分类—农业科学 中国农业出版社《兽医微生物实验诊断手册》第196页(5328字)
有生物活性的抗原与相应抗体结合后,可使其失去原有的生物活性,谓之中和反应。此种中和反应不仅有高度特异性,且具有严格的量的关系。因此可用中和试验以鉴定活性抗原,也可用于相应抗体的定量。主要包括病毒中和试验、毒素中和试验和某些致病酶的中和试验,后者本质上也是一种毒素。
一、毒素中和试验
某些致病菌,如白喉杆菌,破伤风梭菌和肉毒梭菌等,都能产生强烈的外毒素。此外如链球菌的溶血毒素、魏氏梭菌、肠致病大肠杆菌和霍乱弧菌的肠毒素等也都是外毒素,此类毒素都是蛋白质,具有良好的免疫原性,能刺激动物产生具有中和活性的抗毒素。
毒素中和反应机理视抗毒素的性质和作用部位而异。主要有以下二种方式。
1.抗毒素与毒素结合后,直接掩蔽毒素的活性部位,使其失去活性。
2.抗毒素与毒素结合能干扰毒素与细胞受体结合,阻止毒素的活性部分进入细胞。
毒素中和试验有体外法和体内法二种,视反应的性质和试验要求不同,而有很多形式。
(一)体内中和试验
1.毒素单位滴定 以1单位(AU)标准抗毒素,或AU/1000抗毒素与不同量的毒素体外混合后,置37℃1~3小时,分别接种规定的实验动物,记录在指定时间内的死亡数和存活数。使实验动物全部存活的最大毒素量称为无毒限量(Lo)或1/1000无毒限量(Lo/1000),中和后仍能使动物全部死亡的最小毒素量称为致死限量(L+),或1/1000死亡限量(L+/1000)。
有的毒素皮内注射后能引起皮肤红斑,则可用皮内法接种实验动物,能产生皮肤反应的最小毒素量称为皮肤反应限量(Lr)或1/1000皮肤反应限量(Lr/1000)。
2.抗毒素单位滴定 标准毒素不稳定,不易保存,而标准抗毒素十分稳定,故测定抗毒素单位时,必须先用标准抗毒素测定毒素的L+或L+/1000,然后再将待检抗毒素血清10倍递进稀释加入等量的L+或L+/1000的毒素,室温1~3h,接种实验动物,使动物全死或全部存活之间的稀释度倒数,即该血清的终点(AU/ml)。
3.用毒素中和试验滴定破伤风抗毒素,需先用标准抗毒素测定所试破伤风毒素的L+/1000毒素剂量。(1个L+/1000剂量为与1/1000AU的抗毒素混和后,注射0.5ml于小白鼠皮下,能在96小时致死小白鼠的最小毒素量。)然后再滴定抗毒素单位,操作程序如下。
(1)将标准抗毒素用含0.2%明胶的PBS(0.067Mol/ml,pH7.4)稀释成0.004Au/ml,与系列稀释的破伤风抗毒素等量混合,共8~10管,轻轻振摇后,置37℃作用1h,放于4~,8℃直至注射。
(2)取体重15~18g小白鼠,每只皮下注射上述混合物0.5ml。每一稀释度用4~10只小白鼠,每一剂量抗毒素含量为1/1000Au。
(3)观察96h,能全部致死小白鼠的最小毒素量,即为L+/1000剂量。
(4)需滴定抗毒素的血清:置56℃水浴灭活30min。
(5)在一列试管中作1×、10×、100×、1000×、10000×稀释,加入等量每ml1个L+/1000剂量的毒素,每鼠接种混合物0.5ml,每头剂含毒素L+/4000,观察96h,分析结果。
结果举例:如10×稀释全保护,而100×稀释血清全死,则0.25ml的10×稀释血清中含抗毒素量>0.00025AU,0.25ml的100×血清含抗毒素<0.00025AU,故该血清含抗毒素量应为>0.01而<0.1AU/ml,如以对数中点计算,则该血清所含抗毒素量为0.03AU/ml。
4.魏氏梭菌肠毒素分型 魏氏梭菌常见有A、B、C、D四种毒素型,根据其抗原组成的关系,可以用B、C、D三种抗毒素进行分型鉴定。
(1)先测定待检肠毒素对小白鼠的最小致死量(MLD),然后将其稀释成20MLD/ml。
(2)取灭菌试管4支,各加入上述毒素1ml,第1~3管分别加入B、C、D型抗毒素1ml,第4管加生理盐水1ml,置37℃作用40min。
(3)每组各静脉注射小白鼠2只,每只0.2ml,观察24h,第4组小白鼠均应死亡,其他各组结果,按下表作出判断。
表9-14 魏氏梭菌肠毒素定型中和试验
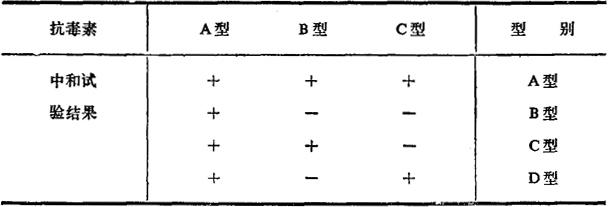
注:+示动物存活,中和试验阳性。一示动物死亡,中和试验阴性。
(二)体外中和试验
1.细胞培养方法 白喉毒素在HeLa细胞上,能阻止细胞蛋白合成,引起细胞病变,因此可在细胞培养上进行毒素中和试验,方法同病毒中和试验。
2.溶血毒素中和试验 一部分键球菌能产生溶血毒素,其中包括溶血素O和S,多数A群链菌球可同时生产二种溶血毒素。测定血清中抗溶血素O抗体试验是将待检血清倍比稀释,加定量的溶血素O,37℃作用30分钟后,加入红细胞悬液。观察结果,能抑制红细胞溶解的血清最大稀释倍数,即该血清的抗键链球菌溶素O的效价。
3.Ramon絮状反应 主要用于测定毒素或类毒素的絮状反应限量(Lf),当毒素或类毒素为已知时,亦可用于测定抗毒素单位,将已知单位的抗毒素倍比稀释,加等量的待检毒素或类毒素,混合后,置37℃水浴,不时观察沉淀反应的出现,反应出现最快,沉淀物最多的一管为抗原抗体结合的最适比。
例如:抗毒素4×与毒素160×的一管出现反应最早,则所测毒素与抗毒素的最适比为1/160∶1/4=1∶40。能与1单位抗毒素结合的最适毒素量即为1个Lf单位,如已知抗毒素含量为0.25单位/ml,则所测毒素的Lf含量可按下式计算:

4.诺维氏梭菌的卵磷脂酶试验用病死动物的腹水或肝坏死病灶的1∶5,1∶10组织悬液,离心沉淀后,取上清液供试,取4支试管,每管加上述试液0.5ml,再于第1~3管分别加入A型、B型和魏氏梭菌A型抗毒素血清各0.25ml,第4管加生理盐水作为对照,混匀后,置室温30min,每管加入卵磷脂卵黄磷蛋白0.25ml,混合后置室温1~2h,观察结果,若对照管中出现乳光层,表明被检材料中含有卵磷脂酶。在1~3管中,此反应被何种抗毒素所抑制(不出现乳光层),即该明此卵磷脂酶为该菌细菌所产生,如第2管反应被抑制,即证明被检材料中含有B型诺维氏梭菌所产生的卵磷脂酶,该动物死于羊黑疫。
二、病毒中和试验
中和抗体与病毒结合后,可使其感染性降低或消失,但抗体只能在细胞外中和病毒,对已进入细胞的病毒,则无能为力。
抗体的中和作用主要是阻止病毒与细胞上的病毒受体结合,阻止病毒吸附。某些病毒,如痘病毒,被抗体包被后,可被吞饮进入细胞,在吞饮泡内使病毒不能脱壳,即使脱壳,其核酸很易被泡内的溶酶体酶所分解,而不能正常复制,有囊膜的病毒在抗体补体的作用下,可使囊膜裂解而失去感染性,病毒粒子的凝聚也可使其感染性降低。
并不是所有能与病毒结合的抗体都有中和活性,如马传贫的补体结合抗体和沉淀抗体,病毒与抗体结合后,仍保持高度感染力,流感病毒和新城病毒的抗血凝集抗体能阻止病毒吸附,具有高度中和活性;而抗神经胺酸抗体则无此活性。
中和试验具有高度特异性和敏感性,不仅可用于病毒的鉴定与定型,还可用于测定抗体的中和活性,并为研究病毒保护性抗原的重要手段。
(一)毒价滴定 中和试验是以能中和一定量病毒的感染力为基础的,因此,必须先测定病毒的感染力,进行毒价滴定。滴定时,需先根据病毒的致病特性选择适合的细胞,鸡胚或实验动物,然后将病毒原液作10倍递进稀释,选择4~6个稀释度接种细胞培养(或鸡胚、实验动物),每组3~6管(只),接种后观察细胞病变(或发病死亡),最后按Reed和Muench法或Körber法计算TCID50(或ELD50,LD50),Körber法较为简易,举例说明于下。
表9-15 病毒TCID50滴定

* 接种剂量为0.1ml。
Kärber法的公式为:

用对数计算。
L为病毒的最低稀释倍数。
d为稀释系数,即组距。
s为CPE比值的和。
本例L=-2,d=-1,s=4/4+4/4+4/4+3/4+2/4+0/4=4.25。
代入公式:

查反对数表可得TCID50=1/560000,0.1ml。
如以ml为单位,则TCID50=1/56000ml
病毒毒价通常以每ml(g)含多少TCID50(或LD50,ELD50)表示,本例病毒毒价为56000TCID50/ml,亦可写成105.75TCID50/0.1ml或104.75TCID50/ml。
(二)固定病毒稀释血清法
1.将事先已滴定毒的病毒原液稀释成200TCID50(或LD50,ELD50),与等量血清混合后,即为100TCID50。
2.血清先用5×稀释,置56℃灭活30min,用Hank氏液倍比稀释。
3.取病毒液与不同稀释度的血清等量混合,在37℃水浴中作用1~2h,每一稀释度接种3~6瓶细胞培养(或鸡胚、实验动物),观察细胞病变(或死亡数)。
4.本试验应设置不加血清的病毒液对照,高浓度血清对细胞的毒性对照,空白对照,必要时还需设阳性血清和阴性血清对照。
5.所得结果按Kärber法计算50%保护量(PD50)。即该血清的中和价,举例如下。
表9-16 固定病毒稀释血清法中和试验举例

上例L=-1,d=-0.3,s=4/4+4/4+3/4+1/4+0/4=3
代入Karber公式,PD50=-1-0.3(3-0.5)=-1.75
该待检血清中和价为10-1.75=1/60。
(三)固定血清稀释病毒法 将病毒原液作10倍递进稀释,分装两列无菌试管,第一列加等量正常血清(对照组),第二列加待检血清,混合后置37℃1h,分别接种细胞培养(或鸡胚、实验动物),记录每组CPE(或死亡数),分别计算TCID50(或ELD50,LD50)和中和指数。

表9-17 固定血清稀释病毒中和试验举例

通常待检血清中和指数>50者即可判为阳性,10~49为可疑,<10为阴性。