烧碱法及硫酸盐法蒸煮液的分析
出处:按学科分类—工业技术 中国轻工业出版社《常用非木材纤维碱法制浆实用手册》第652页(2307字)
1.活性碱的测定
(1)目的意义
测定蒸煮液中活性碱(烧碱法指NaOH、硫酸盐法中指NaOH+Na2S)的含量,可为蒸煮计算用碱量提供依据。
(2)原理
在碱液中加入氯化钡,使之碱试液中的碳酸钠、亚硫酸钠、硫代硫酸钠、硅酸钠等反应,生成白色的钡盐沉淀而除去后,澄清液用盐酸标准溶液滴定,使之与酸液中的氢氧化钠、硫化钠反应,根据盐酸耗量便可计算活性碱量。
NaOH+HCl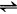 NaCl+H2O
NaCl+H2O
Na2S+2HCl (3)测定方法及结果计算 吸取10ml碱液,置于250ml容量瓶中,加入25ml10%氯化钡溶液,并用水稀释至刻度,充分摇动混合均匀,静置8min左右,吸取10ml上层清液于250ml锥形瓶中,加入2~3滴0.1%甲基橙指示剂,用0.1mol/L盐酸标准溶液滴定至溶液显微红色为终点。 式中:N——盐酸标准溶液的浓度(mol/l); V——滴定时消耗盐酸标准溶液的量(ml); 62/2000——1ml1mol/L盐酸相当于氧化钠的克数。 注意事项: ①稀释用蒸馏水,应尽可能除尽二氧化碳。另外在化验过程中应尽量防止氢氧化钠吸收二氧化碳,以免氢氧化钠转化为碳酸钠,使活性碱量下降。 ②防止把碳酸钡沉淀吸上,否则碳酸钡与盐酸作用会影响结果的准确性,使结果偏高。也应注意快摇慢滴,以免盐酸局部过浓,将可能吸上的碳酸钡等杂质也测定进去。 ③滴定溶液中,过量的氯化钡溶液,其浓度应保持0.1mol/L,以降低碳酸钡的溶解度和消除与盐酸作用的可能性。 ④氯化钡溶液加入试液中,如不再发生白色沉淀时,表示碳酸钠已沉淀完全。 2.硫化钠的测定 方法一:硝酸银氨法。 (1)原理 Na↓(2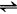 2NaCl+H2S/p>
2NaCl+H2S/p> 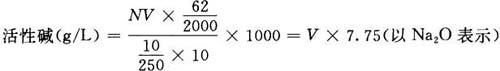
(2)测定方法及结果计算
用移液管吸取碱液10ml,注入250ml容量瓶中,加水稀释至刻度,充分摇匀。吸取稀释后的碱液10ml于250ml烧杯中,用硝酸银氨液滴定,剧烈摇动,待沉淀完全澄清后方可继续滴,直至加入最后1滴硝酸银氨,在清澈的碱液中不显黑色沉淀为止。
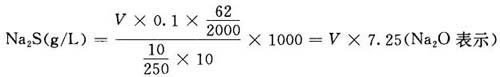
(3)注意事项
在吸取容量瓶中的稀释碱液前,须先将容量瓶内碱液充分摇匀后方可吸之。

氢氧化钠含量(g/L)=活性碱(g/L)-硫化钠(g/L)
方法二:酸碱中和法
(1)原理
利用酸碱中和反应以标准盐酸溶液滴定。由于NaOH、Na↓(2S、Na2CO3的碱性强弱程度不同,被酸中和时有先后之分,故以不同指示剂指示滴定终点。
第一次加入中性氯化钡,使Na2CO3及Na2SO3、Na2S2O3、Na2SiO3等生成相应的钡盐沉淀,以百里酚酞作指示剂,用盐酸滴定中和全部的NaOH和 。
。
NaOH+HCl=NaCl+H2O
Na2S+HCl=NaHS+NaCl
第二次加入甲醛溶液,使NaHS与之作用生成Na〔HCHOSH〕(甲醛化硫氢化钠),以酚酞作指示剂,以HCl滴定,中和全部的NaOH和全部的Na2S。
NaHS+HCHO=Na〔HCHOSH〕
Na〔HCHOSH〕+HCl=H2CHOSH+NaCl
(2)测定方法与结果计算
准确吸取清液5ml于250ml三角瓶中,加约50ml蒸馏水,加入10%的氯化钡5ml,以0.1%百里酚酞作指示剂,用0.5mol/L盐酸标准溶液滴定至蓝色消色。消耗盐酸为A。
再加40%甲醛溶液5ml,过30s用0.1%酚酞为指示剂,以0.5mol/L盐酸标准溶液滴至红色消失,耗盐酸量为B。

注意:若计算中要以Na2S本身的含量表示时,则算式中去掉0.031而乘以0.039。