番茄
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第527页(25684字)
番茄属(Lycopersicon)原产于南美洲安德斯区域。墨西哥开始驯化番茄,从樱桃番茄(L.esculentum v.cerasiforme)野生群体中育成栽培品种。番茄从南美洲扩展到墨西哥,到欧洲18世纪传入北美洲。1950年南美洲野生种遗传信息参入栽培品种得以改进。
(一)研究进展
1.愈伤组织培养 虽然在细胞培养中诱导番茄愈伤组织已获成功,其继续增殖结果,集染色体畸形增多,产生高度多倍体细胞群体(2n=24,4n=48,6n=72…)。经继代一或二次后,第一个征象是多倍体化。非整倍体性也会造成失去芽再生能力。只有野生种L.peruvianum能用以建成愈伤组织培养物,它能在培养下一年后保持芽再生能力。
采用豌豆提取液作为基础培养基的成分不确定附加物,早期研究栽培番茄几种类胡萝卜素突变体愈伤组织启动和生长。Urich和Mackinney(1969)改进这种培养基,发表了很复杂培养基,培养下胚轴、茎和果实组织愈伤组织增殖较好。由于它们的目的在于研究类胡萝卜素生化途径,未观察其再生。但是,用大多数番茄品系继续进行二种观察:人工培养下番茄愈伤组织启动和继续增殖成功,有赖于(a)基因型和(b)用于启动培养体的供体植株的年龄和旺势。他们还用K2SO4防止愈伤组织褐色化,巯脲尿促进细胞分裂。目前大都用较规定培养基,如MS或B5,用于愈伤组织培养。可是,仍常用不肯定附加物如椰乳和水解酪蛋白。
De Langhe和DeBruijne(1976)用经四种CCC处理的番茄族系茎节间外植体培养在LS培养基十IBA,1.0μM+IAA,1.0μM+KIN,1.0μM+2ip,1.0μM,诱导愈伤组织生长。每隔3周继代在LS+KIN,1.0μM上2年以上,这种愈伤组织能保持芽再生能力。愈伤组织转移到LS+ZEA,1.0μM或20%CW芽再生成功。但是,至少在F1子代中30再生植株中有一株观察到遗传变异。
Thomas和Pratt(1981)用野生种L.peruvianum诱导产生松脆、快速生长愈伤组织。它在细胞培养体中培养一年以上,可保持再生二倍体植株能力。可是,随着培养时期增长,四倍体再生植株比例增高。继而产生了异种间杂种品系(L2),在供试L.peruvianum族系中,其愈伤组织生长率和植株再生效率最高。可惜,L2只具有亲体栽培番茄习性的25%。L2在3周内,每1cm叶盘可形成愈伤组织2g。带有分散细胞的悬浮培养体也能保持。将2月龄愈伤组织移至再生培养基1-2月后,能再生二倍体植株。几个月龄的悬浮培养体曾再生二倍体芽。
番茄愈伤组织培养最早用于类胡萝卜素合成生化研究。作者假定,由于愈伤组织细胞是全能性的,那末培养的番茄愈伤组织应能合成为任何特定番茄基因组编码的全部类胡萝卜素。可惜,他们的培养条件促进结实,但不是叶内类胡萝卜生产,即使用下胚轴作为启动愈伤组织的外植体。
其它研究报道指出完整植株水平上表达的功能,愈伤组织未能出现。例如,Ellis(1978)采用从下胚轴启动的非光合细胞悬浮培养体,试图分离出对Metribuzin敏感性低的番茄。虽用了一系列不同敏感性的番茄品系,在其相应细胞悬浮培养体的生长上,未观察对这种除莠剂的不同反应。
比较了器官培养(根尖)与愈伤组织培养对外给糖的吸收。观察到二者对不同糖类的吸收和生长和吸收率方面有差异。
Tal等(1978)研究L.peruvianum愈伤组织培养物的耐盐性。番茄叶、茎或根组织启动的愈伤组织对盐反应相同。这二个耐盐野生种的愈伤组织,在含盐细胞培养条件下,比敏感性栽培种番茄的增殖程度较大。这指出野生种在细胞水平上渗透压调节能力较强,并与完整植株的组织化无关。可知愈伤组织细胞培养可能特别适用于研究耐盐机理。
Liebisch(1980)证实了番茄细胞悬浮培养体表现了与其完整植株相同的酶的基因转变和各种赤霉素的代谢。这为研究这些植物荷尔蒙提供着一种简便的人工培养体系。
番茄愈伤组织也曾用于分离遗传变异体。与其它作物种不同,如烟草和禾谷类,在悬浮培养体中进行有效地分离突变体所必需的松散番茄愈伤组织,除L.peruvianum外,都未获成功。Thomas和Pratt(1981,1982)用L2异种间杂种成功地分离出耐除莠剂(Paraquat)增强的变异体。根据自交和与野生型,(paraquat敏感L2)杂交试验,继之测验了从子代产生的愈伤组织的耐性,设想它们或是突变等位基因的杂合体。R0和有些R1植株观察到耐性增高的事实,提出着L2族系适用于分离突变体。
Meredith(1978)用栽培番茄的愈伤组织和植板的悬浮培养体选择抗铝变异体。后者高度稳定,但培养的细胞是高度多倍体,未能再生植株。
芽培养是用于分离突变体和芽再生试验的另一方法。番茄芽再生与预先的愈伤组织增殖,都在芽再生培养基上完成。Evans和Sharp(1983)证实了栽培番茄叶外植体的芽培养可诱变的。他们取得了12个核、单基因、形态突变,一个可能是核单基因突变经有丝分裂重组表现为二倍体。全部突变经有性传递给以后世代,表现简单孟德尔遗传。由于230再生植株中没有观察到嵌合体,显然突变发生于芽形成前的愈伤组织细胞中,每个突变体是从单个突变体细胞产生的。这些结果提出叶外植体再生植株可用于迅速将遗传变异性引入栽培番茄。
愈伤组织培养也曾用于植物病理学。愈伤组织是研究抗病和敏感机理的有效手段。例如,Warren和Routly(1970)用以研究对真菌病原菌Phytophthora infestans单基因(Phi)抗性性质。细胞培养体适于作为密闭系统,其中没有温室或大田所有的别的病原菌。
最后,Doering和Ahuja(1967)采用(番茄×L.chilenseF1)×第二个番茄品种多次回交产生的番茄品系的愈伤组织培养基研究一种显性类肿瘤条件。发现愈伤组织培养体能用以从非肿瘤植株鉴别出肿瘤植株,以不同类型的和荷尔蒙用量的生长反应,以及肿瘤愈伤组织对供试全部生长调节剂组合的较高生长率为依据。由此可知,愈伤组织培养体适用于研究正常与肿瘤组织间代谢差异。
2.胚培养 胚培养用于拯救受合子后障碍的有性杂交杂种植株。Smith(1944)首次采用这种技术分离番茄×L.peruvianum杂种。从此用此产生了番茄×L.peruvianum杂种和番茄与Lperuvianum不同品种间的杂种。Rick和Smith(1953)用番茄×L.peruvianum和番茄×L.chilense胚培养杂种研究这些杂交的遗传性质。De Natfancourt等,(1974)用胚培养产生的番茄×L.peruvianum杂种研究自交和异交不亲和性的遗传和超量微结构。他曾将种间杂种与各种番茄品种回交取得有限成功,用于评价抗病性和农艺性状(Ancora等,1981)。Hogenboom(1972)取得了自交亲和L.peruvianum品种,并与番茄杂交亲和。胚培养技术也适用于取得异属间杂种番茄×Salanum lycopersicoides。
Thomas和Pratt(1981)研究将L.peruvianum的愈伤组织快速增殖和芽再生特性引入番茄。他们用胚愈伤组织培养从未成熟种子取得二倍体杂种植株,植板效率为4%。这种胚愈伤组织培养体表现了L.peruvianum亲本的上述二种特性,由此支持着将它们引入番茄。
3.根培养 1900年代早期开始蔬菜作物(包括番茄)的根培养。Robbins(1922)和Kotte(1922)首先报道游离根尖培养成功。White(1934)用加酵母浸出液的培养基建立一种培养系统,游离番茄根可在这种培养基上无限期地保持。自后,多数学者集中于测验番茄根培养的特定营养成分,这些是延长根在细胞培养体中长期生长所必要的。
White(1934)指出了将番茄根培养体生长在15℃代替25-27℃,继代间隔期可增长1-8周,不会降低组织成活率。可是,Petru(1965)发现日/夜温度从23-24℃/20℃降低到19℃/16℃,14天,在放回到较高温度下6周期间,根培养体逐渐衰老和死亡。他也说启动培养基pH愈低(4.9),最有益于游离根培养。Norton和Boll(1954)从L.peruvianum根首先诱导愈伤组织生长,再生芽成功。
White(1934)将烟草嵌合病毒(TMV)保持在培养的烟草根内。Street和Melhuish(1965)用番茄根组织和器官培养研究代谢产物尤其是氨基酸的释放。Chin等(1981)采用根培养与愈伤组织培养细胞研究离体番茄根糖吸收和代谢。
用番茄叶盘培养测验根器官建成。Coleman和Greyson(1977)采用改进的MS琼脂培养基,研究各种生长素和赤霉酸对根启动的效果。Coleman等(1980)也研究了乙烯与生长素对根器官建成的互作效应。
4.芽培养 番茄芽再生是器官建成而不是胚胎发生结果,并要先经启动愈伤组织增殖时期,后者为外源合成生长素所促进,或在再生培养基加生长素和细胞分裂素。番茄外植体产生的愈伤组织量和芽再生效率,视下列变数而定:(a)培养基中的生长调节剂种类和浓度,(b)供体植株生长条件,(c)供体植株年龄,(d)选择的外植体,(e)供体组织部位或年龄,和(f)供体植株基因型。表3和4列出发表过芽再生培养基,用于番茄品种和野生番茄种。
Norton和Boll(1954)首次报道细胞培养体内番茄芽再生。是从L.peruvianum根培养诱导的愈伤组织上取得的芽。De Langhe(1973)从栽培种番茄茎外植体愈伤组织再生了芽。
Pedmanabhan等(1974)研究IAA与KIN各种组合对番茄一个正常和二个突变体族系叶外植体芽再生的效果。他们从在MS+IAA,22.8μM+KIN,18.6μM培养基上启动的愈伤组织芽再生成功。约8-25%外植体产生了芽。报告指出产生的愈伤组织量与外植体的形态建成潜力无直接关系。愈伤组织生长最多的番茄族系,芽再生频率并非最高,品种专化的植株生长旺势,也与愈伤组织产生和芽再生效率无关(表22-1,22-2)。
表22-1 番茄栽培品种的芽再生
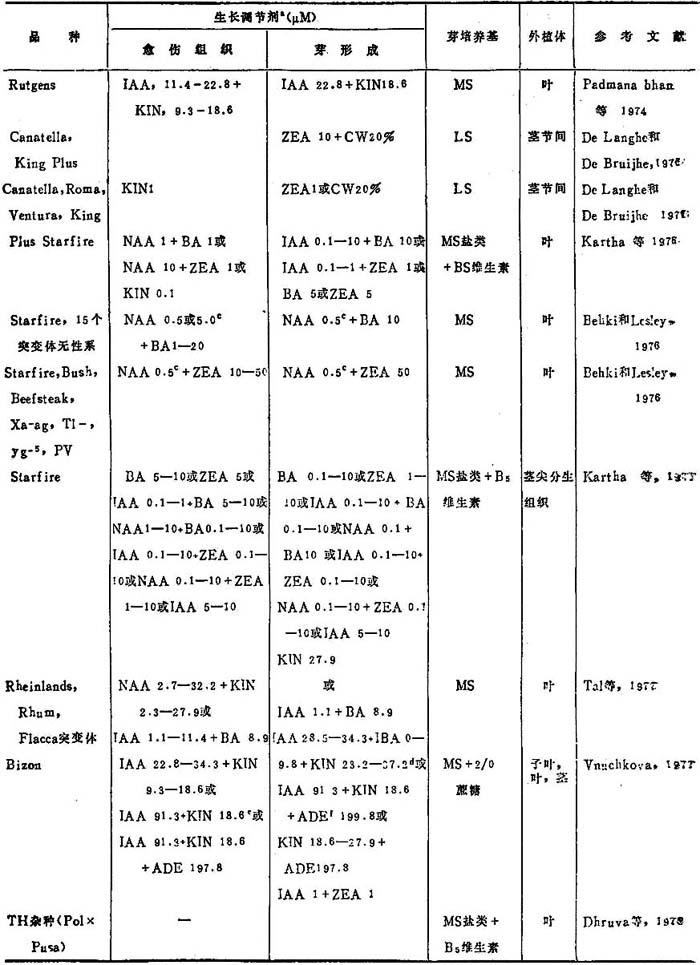
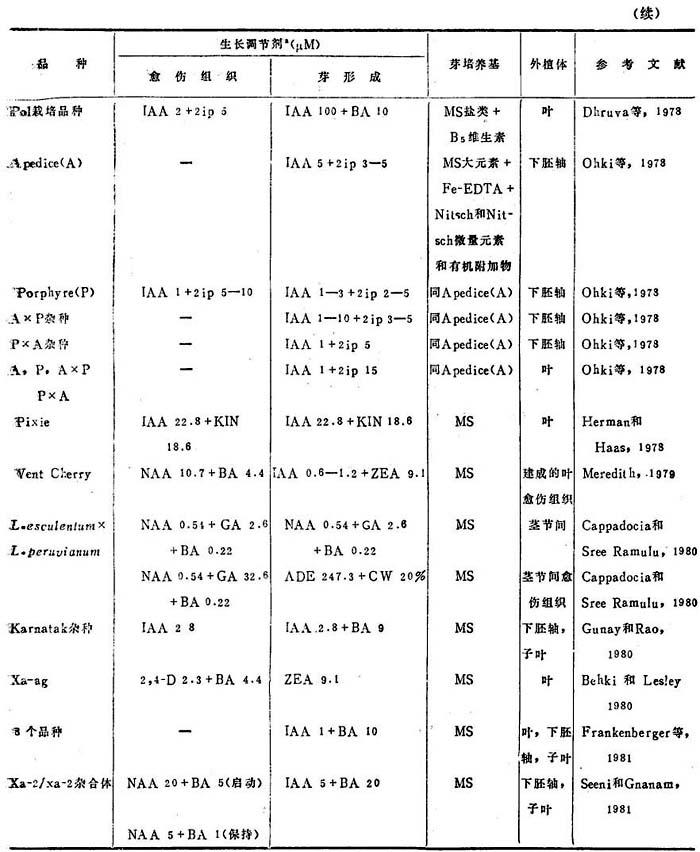
a.所列浓度诱导最高频率反应用量。
b.各种叶绿素、形态的和营养缺陷型突变体:yg-1;yg-2;yg-4;yg-5;yg-6;Xa-1;Xa-2;Xa-ag;sufaw,d;pe-lg;t;1-dcary;Yv-co; pv; Tl-。
c.所列浓度诱导大多数供试族系发生反应,但并不一定最适于任何一个特定族系。
d.在秋、冬月份启动的愈伤组织最后芽再生的最好组合。
e.最后芽再生的最好组合。
f.春夏月份期间启动的愈伤组织最后芽再生的最好组合。
表22-2 野生种和有关种的芽再生
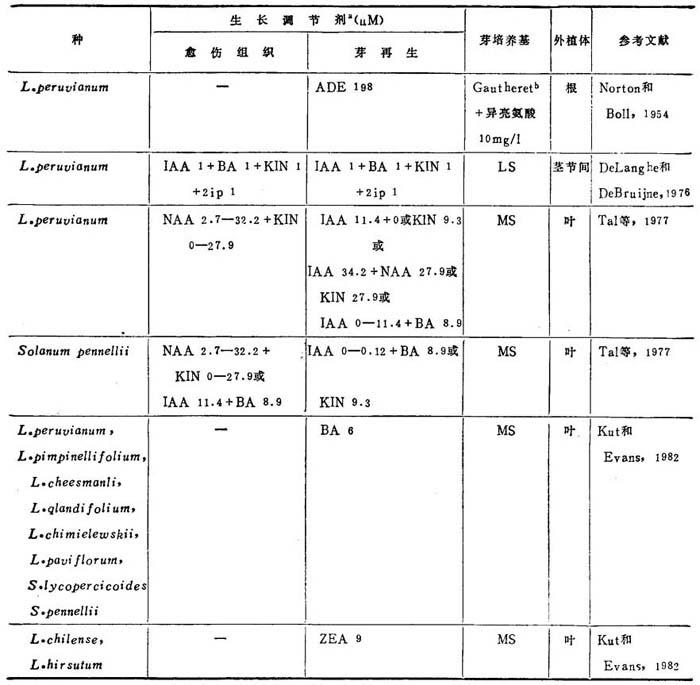
a.所列浓度诱导最高频率反应,b.参看Street和Shillito,1977。
Behki和Lesley(1976)研究番茄15个突变系和二个商业品种在各种NAA+BA和NAA+ZEA MS培养基上的形态建成反应。全部克隆在NAA0.5或2.5μM+BA20μM上产生愈伤组织。芽再生的最适生长调节剂浓度,在供试遗传品系间有相当大差异。用NAA0.5μM+BA10μM有10系再生芽,其余2系的再生需要较高BA或较低NAA。Padmanabhan等(1974)报道的再生芽的最适植物荷尔蒙组合只适用于12系中的3系。比较一个无性系的叶与茎外植体在相同荷尔蒙组合中的形态建成比较研究,反应显着不同。用ZEA代替BA用于6个无性系的再生,一般胜过BA。满足6系再生的最适组合是NAA0.5μM+ZEA50μM。
De Langhe和DeBruijne(1976)研究番茄4个栽培品种和L.peruvianum一个族系茎节间愈伤组织的芽再生。后者长芽效率最高。附加2种生长素和2种细胞分裂素(即IBA 1.0μM+IAA 1μM+KIN 1.0μM+2iP 1μM)的培养基反应最好。而用于番茄4个栽培品种则未能生芽。用ZEA10μM使番茄20-40%再生。GA31.0或10μM愈伤组织显着增殖。有些情况下,ABA刺激芽形成,但其它则受抑制。De Langhe和DeBruijne(1976)根据这种设想:番茄芽再生频率较低,可能是由于内生GA3水平高,在培养基中附加CCC 1000ppm对芽再生并无影响。但是用2000ppmCCC水溶液预处理茎外植体的供体植株,刺激了芽再生。从这些预处理植株的外植体愈伤组织,能保持在附加KIN1.0μM培养基上,每隔3周继代一次。芽从保持在这种培养基上2年的愈伤组织,经转移到ZEA 1.0μM或CW 20%培养基后,能产生带根的正常芽。这设想了在长期愈伤组织培养体中保存遗传稳定性。观察234再生植株中,未见形态变异性。但是,其中30株F1群体内的确出现一株变异体。这指出了作物植株细胞培养繁殖中,至少会产生若干遗传变异性。
Kartha等(1976)以建立芽再生高频率的培养系统为目标,研究了番茄品种Starfire叶切段对各个植物荷尔蒙和多种组合(浓度范围0.1-10μM)的形态建成反应。供试的BA和ZEA(每种用量5μM),对叶切段发生最佳形态建成反应,形成多芽和根。BA胜于ZEA,芽发育早。5μM KIN诱导芽形成不稳定,但0.1μM KIN是诱导愈伤组织的最好细胞分裂素。DeLanghe和DeBruijne(1976)观察到茎节间在低浓度KIN中的相同反应。IAA和NAA二者都能诱导愈伤组织生长和根形成,但无芽再生。BA+IAA诱导芽再生比BA+NAA为好。不论IAA浓度为何,BA 10μM诱导产生多芽。BA+NAA则对芽形成不稳定。KIN+IAA和KIN+NAA只是愈伤组织和根生长,KIN 10μM+NAA 0.1μM取得少数芽。像BA情况一样,ZEA+IAA的芽再生效率比ZEA+NAA为高。ZEA0.1μM+IAA0.1或1.0μM形成多芽。由此诱导芽再生的ZEA+IAA浓度范围较BA+IAA为广。除ZEA 1.0或10.0μM+NAA0.1μM产生少数芽外,ZEA+NAA以长愈伤组织为主。各种荷尔蒙组合对芽再生效果如下(依下降顺序排列):ZEA+IAA,BA+IAA,ZEA+NAA,BA+NAA,KIN+NAA和KIN+IAA。这些结果提出外源生长素水平,除需强生长素如NAA外,芽再生还需要比KIN强的细胞分裂素。必须建成细胞分裂素-生长素平衡以达到形态建成。
Kartha等(1977)用品种Starfire7日龄幼苗茎尖分生组织取得高频率芽再生。茎尖分生组织可用于从侵染植株产生无病毒植株,或克隆需要的基因型。分生组织细胞比更成熟组织如叶,生长更快,产生更一致的二倍体植株。由此Kartha等(1977)提出了分生组织培养可能提供更有效的植物繁殖系统,结果产生的多倍体染色体畸变植株较少。诱导高频率芽再生的荷尔蒙浓度比叶外植体的更大(Kartha等1976,见表3)。单用BA和ZEA也能再生芽,其频率90-95%。若干浓度的BA+IAA取得芽再生最高频率,若干浓度的BA+NAA.也生芽。ZEA+IAA再生效率比BA+IAA稍低,ZEA+NAA仅稍低于ZEA+IAA。单用.IAA 1.0-10μM能诱导同等频率芽再生,单用同样浓度NAA再生频率低。
Tal等(1977)比较研究番茄软弱(flc)突变体叶与L.peruvianum和Golanum pennellii叶的再生。L.peruvianum供试系形态建成潜力最强,其次是S.pennellii,而flc突变体在所有荷尔蒙组合中再生频率极低。与正常栽培品种相比,后者具有的内生荷尔蒙不平衡,对其再生潜力无影响。由此,不能仅就L.peruvianum含有内生ABA较低说明它的再生频率较高。Kut提出L.peruvianum的形态建成高潜力,可能与这种自交不亲和种的高度杂合性多少有关。
Vnuchkova(1977)测验了用于番茄品种Bizon诱导愈伤形成和芽再生150种培养基。她发现含氮量高的培养基,结果使外植体很快变黑和萎缩。营养缺乏的培养基,如White氏培养基(1943),也无益于生长。较高用量的许多维生素如抗坏血酸和烟酸也无效。她也观察到番茄外植体对培养基内水解酪蛋白或酵母浸出液也无反应。
Vnuchkova注意到,几种浓度和组合的荷尔蒙虽能诱导产生愈伤组织,只有较紧密愈伤组织能诱导生芽。紧密愈伤组织生长,需要较高荷尔蒙浓度。2,4-D倾向于诱导松散愈伤组织生长,不适于再生。她观察到诱导外植体芽分化所必需荷尔蒙类型和浓度,有赖于年生长季温度,因此,可能与荷尔蒙内生浓度有关。把茎芽培养在5000-100001x光强下,以较高频率发育成再生植株。
Vnuhkova取得的许多再生植株的育性降低。愈伤组织培养体的细胞学研究,观察到高度多倍体化(每细胞染色体高达200个),和落后染色体、染色体桥和片段。多倍体化是核内有丝分裂结果,第三次继代后急剧上升。能以找出平稳增高愈伤组织、减少染色体反常性的最适培养基。她发现在培养基中增加腺嘌呤能增高愈伤组织再生潜力。已有报道腺嘌呤促进二倍体细胞生长,对多倍体愈伤组织有抑制作用。
Ohki等(1978)仔细研究已知种的离体培养芽再生能力的变异率,和这种能力经杂交的传递力。发现芽形成效率,依赖于(a)植株基因型,(b)用作外植体的组织和器官(内生生长调节剂种类和浓度),(c)切取外植体的植株部位(内生生长调节剂的不均匀分布和组织学结构不匀称),(d)器官成熟度(随发育前进,生长调节剂种类和浓度改变;表现特殊生理学功能细胞,增高诱导分化难度,不再能进行活跃细胞分裂),和(e)培养基里的生长荷尔蒙种类和浓度(关键的细胞分裂素生长素平衡)。
Ohki比较杂种与亲本的再生能力结果,指出其依赖于培养基的荷尔蒙浓度。亲本Por-phyre(P)比另一亲本下胚轴外植体常表现较高再生能力。在一种培养基上,二个杂种下胚轴器官建成能力界于二亲之间,表现基因组间互作。另二种培养基上,P×A比A×P杂种再生芽较多,表现芽再生的母本效应。P×A杂种再生芽数也比二个亲本的都高,表现杂种优势,而A×P的再生芽数界于二亲之间。用相同试验方法,测试叶外植体的芽再生差异甚大。叶切段之再生需要较高用量细胞分裂素,和细胞分裂素与生长素比率10-20:1。第二,由于各个叶外植体界再生差异率很大,亲本系间和它们杂种间再生能力无明显不同。亲本A叶的再生效率可比亲本P的高。分析下胚轴和叶外植体的植株再生,指出了约有10%形态反常,如卷曲、叶小、厚、节间短,粗,和/或花小而不育。有些形态反常植株和形态正常植株是四倍体(4n)或混倍体(2n+4n)。如果将细胞培养用于植株繁殖,必须考虑到遗传变异体的出现,并用最适培养条件使之减少。
Herman和Haas(1978)研究番茄外植体的芽再生的起源。将叶愈伤组织反复继代,观察到只有连续带芽或叶组织片段的愈伤组织才能形成新芽。将不带芽或叶组织的愈伤组织切块与带有生长中芽的愈伤组织共培养,未见刺激无组织愈伤组织进行器官建成。这些结果提出了番茄再生芽只能来源从外植体分化组织上不定芽生长的结果,而不是愈伤组织形成后重组织化的结果。但是,以后从解离的或重组织的愈伤组织取得了芽。
Meredith(1979)从已建成的愈伤组织培养体研究番茄芽再生。初步试验采用番茄四系和L.pimpinellifolium,系愈伤组织和细胞悬浮培养体,它们已培养了17-28个月,以后试验采用4月龄愈伤组织。她只是从一个基因型VFNT Cherry芽再生成功。它的叶愈伤组织比花药的表现形态建成较好。单用三种细胞分裂素(BA,2ip和ZEN)都能诱导芽再生,以ZEA产生的芽最多。在芽诱导期间,低水平生长素是防止连续转移时失去生长旺势所必需。最老愈伤组织培养体再生需3-5月,幼愈伤组织只要2月。幼愈伤组织再生形态正常芽,且易生根,而老愈伤组织再生芽形态上不正常,无根形成。
Cassells(1979)试图增多每个外植体再生番茄芽数。最多有6个芽,大多数实验室只能1-3个芽。采用各季生长植株的外植体,他注意到在外植体尖端形成了生长较慢、紧密愈伤组织,从后者产生了1或2芽。这些启动芽产生的顶端优势,可用芽切段和/或愈伤组织继代到新鲜培养基上予以克服。培养基附加TIBA(2,3,5-三碘苯甲酸)0.2μM,在外植体全长上诱导产生了愈伤组织,而不是局限于切口端。采用TIBA沿着茎外植体形成芽,频率较高(每个外植体31个对1.7)。但是,夏季生长植株的外植体,无论用TIBA处理与否,芽再生效率无差别(每个外植体30芽对30芽)。他的结果提出内生生长素浓度的季节变化,影响着芽再生能力。
Cappadocia和Sree Ramulu(1980)改变再生培养基的荷尔蒙含量,诱导茎节间外植体再生芽成功。做法是培养基附加高水平ADE和CW,不加生长素。但是,这种继代的愈伤组织再生四倍体百分增高,占再生植株的50%,但开始时的再生植株中只有25%是四倍体。
Gunay和Rao(1980)研究栽培番茄杂种的下胚轴和子叶外植体的繁殖。下胚轴外植体对许多荷尔蒙组合生芽的反应,比子叶外植体的为强。供试生长素是BA,KIN,IAA和NAA。诱导100%培养的外植体产生芽形成的最好组合为BA+IAA,BA+NAA和KIN+NAA未见芽形成。
Behki和Lesley(1980)提出了诱导叶外植体愈伤组织的最适培养基,并能产生最高频率芽再生。首先研究氮源对芽形成影响,发现将MS培养基含氮总量减少到80%以下,抑制了芽再生,好比用与NO3-等量或超量NH4+结果一样。可是,NO3-可代替NH4+而对芽再生无不利效果。他们继而发现叶愈伤组织的芽再生成功,有赖于诱导愈伤组织和芽分化培养基中的生长调节剂种类和浓度,以及转移到芽分化培养基前在前者中培养时间长短。用Xa-ag诱导愈伤组织生长素初步试验结果如下:(1)单用IAA诱导根生长旺盛,IAA+BA愈伤组织生长改进。(2)单用NAA诱导较硬愈伤组织和根。NAA+BA抑制根生长,而诱导白、松散愈伤组织生长良好。(3)单用2,4-D很快刺激白、松散愈伤组织很快增殖,除非用量是0.18μM,外植体启动12天内,转移到芽分化培养基上,否则不能诱导芽再生。2,4-D+BA诱导Xa-ag克隆外植体产生愈伤组织,至少在接种后18天内,能保持形态建成潜力。(4)只有光培下诱导产生的愈伤组织,才有在芽分化培养基上继续形态建成能力。
Frankenberger等(1981)测验了外植体给源和供体植株生长条件,对8个不同番茄品种芽再生影响。秋季的较幼植株(6周龄)叶外植体(取自最接近茎尖分生组织或叶柄部位的小叶)芽形成能力显着较高。另一方面,春季植株叶成熟度与芽形成能力无影响。春季生长比秋季生长植株的芽再生能力减低3倍,证实了Vnuckkova(1977)和Cassells(1979)的结果。人工培养的和温室生长幼苗下胚轴和子叶试验结果指出,外植体给源和供体植株生长环境,对每个基因型的产芽数都有显着影响。反之,Gcmey和Rao(1980)认为子叶比下胚轴外植体产生更多芽。人工培养绿幼苗比温室生长幼苗产生更多芽。上述全部结果强调着当进行再生试验时,要注意供体植株生长的环境条件和外植体来源。
Frankenberger等(1981)深入研究芽形成遗传基础,发现芽再生能力与外植体供体生长习性间无相关。用芽形成能力差异大的6种基因型的全部双列杂交,研究这种特性遗传力。发现芽形成能力高度遗传的。这些杂种间芽形成能力的大的变异性,归之于加性基因作用,而3种芽形成高基因型中的2种,与隐性基因有关。
Kut和Evans(1982)研究8个番茄属和2种血缘密切的茄属种叶外植体在MS培养基附加8种不同荷尔蒙组合(前已发表)上的再生潜力,与栽培番茄相比较。鉴别出MS+BA5μM,对普遍适用于大多数种的再生。L.peruvianum,S.lycopersicoides和L.gandifoliμm再生反应最好,在附加ZEA9μM时,L.chilense的反应相当。L.hirsutum最难于再生。只有一种生态型在上述培养基上培养13周后一种外植体(供试的3种中)产生一个芽。迄今从第二种生态型得到一个芽。在细胞培养体中长期保持的这三种生态型,再生了更多芽。除L.hirsutum和L.pimpinnellifolium外,全部供试野生种再生能力,比番茄的更好。
Cappadocia和Sree Ramulu(1980)建立了自交不亲和(SI)番茄×L.Peruvianum杂种芽培养,研究L.peruvianum控制的SI等位基因与控制单向异种间不亲和性(USI)等位基因间互作。L.peruvianum表现SI的配子单因子系统,四倍体化可使之变成自交亲和性(SC)。在同一个花粉粒里,SI位点上有二个不同等位基因存在时,消除和了这种不亲性表型。四倍体细胞培养体再生二倍体杂种,证明是SI,异交不亲和性与二倍体杂交的反交,再生另一四倍体。这种情况中,对SI没有异等位基因花粉效应,指出SI与USI等位基因的功能相互独立无关,相互不能补充。再者,Ancora和Sree Ramulu(1981)研究自交不亲和性L. peruvianum的再生,指出SI位点上存在异等位基因花粉是必需的,但不足以建立SC。
Seeni和Gnanam(1981)建成番茄芽培养体,研究嵌合体的产生。Xa-z叶绿素突变杂合体黄-绿植株(Xa-2/Xa-2)再生芽中,有10-15%是嵌合体。同质绿株(Xa-2/Xa-2)或同质白化株(Xa-2/Xa-2)未见再生嵌合体。这些嵌合体的叶有深绿色、黄-绿色和白色区域。从这种区域中每个区域,能再生产生那种颜色的纯合体。虽未能决定特种颜色区域再生植株的基因型,这些试验指出在细胞培养条件下,有丝分裂细胞中,产生着分离或重组,意味着芽培养适用于取得育纯的植株基因型或表型。
5.花药和花粉培养 花药或花粉培养产生单倍体,可以比常规育种方案较短时期固定和分析杂种植株(包括异种间杂种)的新遗传组合,建立育纯番茄品系。单倍体细胞培养也能处理分离突变体、体细胞原生质体融合和遗传工程技术。但是,由于取得番茄单倍体和双单倍体植株频率低,重现少见,达到这些目标仍有困难。
产生单倍体的效率,取决于5种变因:(a)供体植株生长条件。(b)取花药时花粉细胞发育时期(番茄以花粉母细胞减数分裂期最好)。(c)细胞培养基:培养基组分应能最适于单倍体愈伤组织和芽产生,使母体组织生长以及随培养时间而多倍体化降到最低。(d)诱导单倍体愈伤组织的基因型潜力,和(e)培养的愈伤组织再生单倍体和双单倍体的基因型潜力的差异。表22-3列出了产生单倍体和或单倍体芽已发表的生长条件。
表22-3 番茄花药和花粉培养
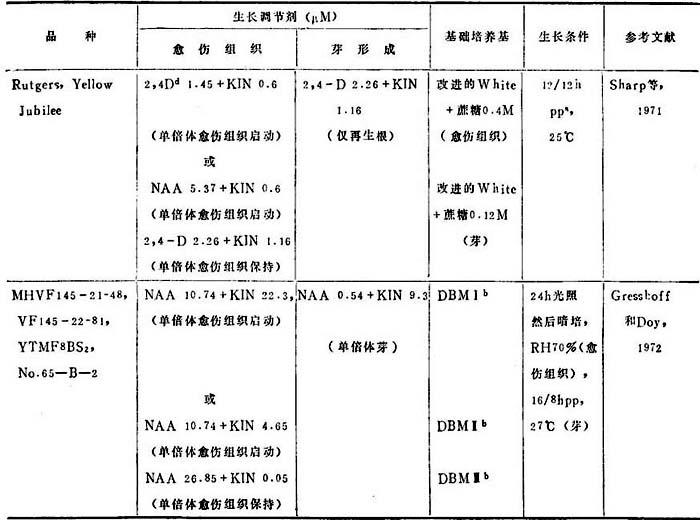
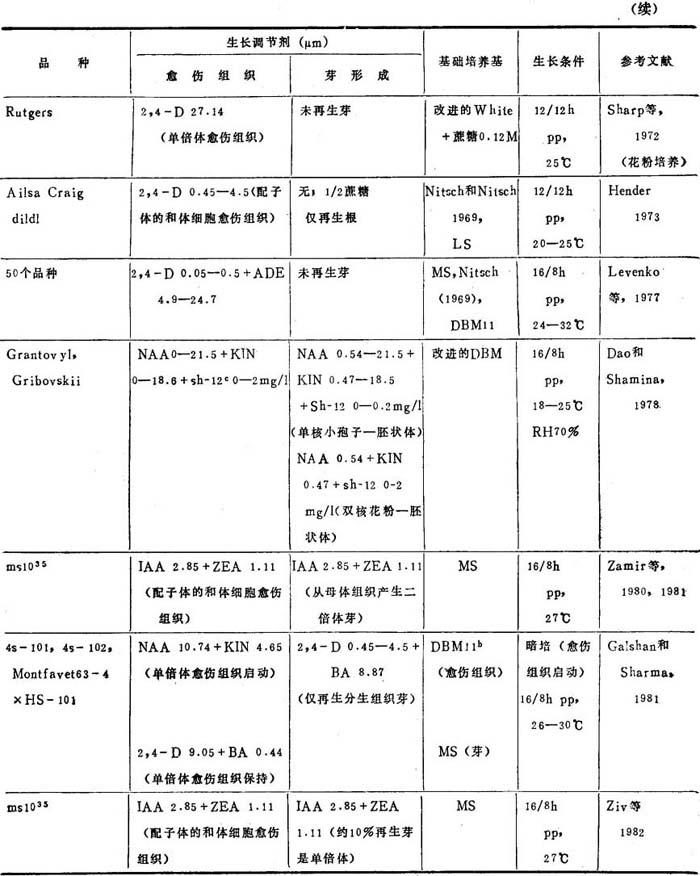
a.光周期:小时光培/小时暗培。b.Gresshoff和Doy基础培养基(1972)。c.一种生物诱变剂(同前)。
显然,单倍体和双单倍体芽是从愈伤组织发生器官建成的结果,而不是通过雄核发育的。但是,Dao等(1976)用单核小孢子时期花粉细胞培养,观察到胚胎发生,这是三种发育途径之一。胚在16-20细胞期败育。其余二种发育途径是产生愈伤组织和正常小孢子形成。后者终于退化。培养四分子期花粉细胞(减数分裂结束)产生小孢子形成。花粉母细胞减数分裂早期愈伤组织增殖最盛。Dao和Shamina(1978)从二核花粉产生胚。这些胚状体在16-32细胞期退化。Cappadocia和Sree Ramulu(1980)从番茄×L.peruvianum杂种花药培养观察到球形胚,发育32细胞期。这些胚和仅有愈伤组织增殖情况,只有从单核有丝分裂后期的小孢子才能诱导产生。
番茄花药培养大都集中于研究最适培养基成分,或各种予处理对花粉细胞的影响。Sh-arp等(1971)发现附加ADE,YE,CH或CW对培养的番茄花药很少促进或不生长。增高蔗糖用量,花药产生愈伤组织百分增高,0.4M蔗糖达到最高约43%。单倍体愈伤组织在离体培养下保持7个月。用这种愈伤组织诱导进行器官发生,当转移到蔗糖减少到0.12M培养基上,结果生根但无芽。
Greenhaff和Day(1972)用他们设计的培养基,从43个供试品种花药中3个取得了单倍体愈伤组织。减数分裂早期花粉母细胞产生愈伤组织频率最高,50-70%。仅在吸涨的花粉囊暴出花药壁后才能观察到。其它愈伤组织,尤其是花丝部分,都来自二倍体组织。再生了叶形态反常的单倍体。把从直径1cm无种子假果的产生,进一步证实了单倍体愈伤组织全能性,这是在芽分化培养基上培养10周的愈伤组织转移到DBM 11+NAA26.85μM+KIN9.3μM后取得的。单倍体愈伤组织保持在人工培养下达1年。以后转到附加生物素8.2μM+泛酸钙2.1μM,刺激了愈伤组织生长率。
Devreux等(1976)从L.peruvianum花药产生愈伤组织。但仅从母体组织再生了二、四倍体和嵌合植株。
Levenko等(1977)提出荷尔蒙比例和浓度,对产生愈伤组织有重要作用,而基础培养基中的矿质盐类不是这样。附加花药提取液、山毛榉叶或phytohemagglutinin可使愈伤组织诱导频率(4-50%)加倍,但植板在已经长过愈伤组织的培养基上,并无影响。初次愈伤组织培养物中多倍体和非整倍体与单倍体细胞比率,基因型间有不同,(从75-100%多倍体+非整倍体),但因培养时间而增高,指出必需在愈伤组织发生后立即诱导单倍体芽形成。无见芽再生。
Cappadocia和Sree Ramulu(1980)在4℃用2,4-D45.2μM预处理带有有丝分裂单核后期小孢子的芽6h,愈伤组织增殖增多4倍。但只有从母体组织再生了二倍体植株。
Zamir等(1980)依据低温预处理烟草等种花药破坏正常小孢子发生而增加了单倍体,研究用15种非等位基因的、隐性、雄性不育(ms)番茄植株产生单倍体芽。只有ms1035突变体诱导产生愈伤组织相当高增殖。把这种突变引入原先在花药培养中不长愈伤组织的几种基因型中后,观察到显着愈伤组织生长。ms1035突变表现花粉发育停留在减数分裂四分子期。带有部分单倍体细胞的愈伤组织,都是从发生减数分裂被破坏后立即培养的花药中(长1.5-2.5mm)。可是,这种愈伤组织是高度多倍体,并是从花药壁细胞诱导产生。花药培养基蔗糖浓度58.4μM,有利于愈伤组织增殖,而29.2μM时,有利于芽形成,其倍数性水平未见报道。
Zamir等(1981)采用同样培养系统,带有形态的和同工酶标记杂合体的ms1035突变体植株。根据这样标记的分析,从它们的花药产生的再生植株混倍体愈伤组织是从母体二倍体组织产生的。
Gulshan和Sharma(1981)诱导单核早期小孢子的花药愈伤组织增殖成功。含NAA+KIN培养基只能使孢子体组织产生愈伤组织。体细胞组织无反应。2,4-D+BA组合则促进二种组织类型产生愈伤组织。可是MS+2,4-D+BA最适于保持愈伤组织,可见在细胞培养中,植株发育的不同时期需要的营养物质很不同。Gresshoff和Doy的DBM 11(1972)是诱导愈伤组织最适基础培养基。虽观察到许多分生组织瘤,未能芽再生。培养中小孢子发育的细胞研究,其中只有约3%能最后发育成愈伤组织。它们的第一次有丝分裂是对称的(雄核发生“B”途径)。转移到芽分化培养基上愈伤组织形态建成研究提出,为了取得芽再生,要有不同生长调节剂如2,4-D+NAA+BA+KIN。
Ziv等(1982)用ms1035突变体,和Zamir等(1980)的培养系统,和一个标记基因,再生成功,证实双单倍体同质植株。Zamir等(1980)报道凡是引进ms1035基因的所有栽培品种产生花药愈伤组织有显着正效果。虽其量视导入ms1035的栽培品种而定。但ms1035对芽再生无明显作用。还有ms1035基因对诱导愈伤组织的剂量效应,例如一种基因型的不同植株的影响:纯合不育株是25%,杂合能育株是14%,纯合能育株是5%。蔗糖浓度高于29.2mM或低于14.6mM,能严重降低愈伤组织和芽产量。较低蔗糖浓度对愈伤组织产生促进作用程度但不影响芽再生,有赖于基因型。
花粉培养是取得单倍体植株的另一方法。培养游离花粉细胞,消除着来自二倍体细胞和植株的配子体的或体细胞的混淆。Sharp等(1972)首次报道用看护培养法培养游离番茄花粉成功。在液体培养基中,用解剖针撕去花药壁,取得游离花粉细胞。看护培养的制备:(a)从1cm花芽取完整花药球果,平放在琼脂培养基上,(b)将一张无菌滤纸盖在花药球果上,和(c)吸取约10个花粉细胞放在滤纸上。植板效率从0到60%。取得了单倍体愈伤组织克隆,未道及芽再生。
6.原生质体 Gregory和Cocking(1965)就分离出Lycopersicon种的原生质体。但在培养中退化了。只有二个种叶肉原生质体再生植株。Zapata等(1977)用L.peruvianum原生质体首次取得再生。最近Morgan和Cocking(1982)从栽培番茄品种Iukullus也再生成功。
由于番茄原生质体性质松脆,着重注意供体植株的生长状态。已证明光强4000-80001x最适于释放活原生质体。Cassells和Barlass(1976-1978)报道生长于高光强中的植株含果胶钙十倍于低光强中的。前者需用较高酶浓度释放其叶的原生质体。供体一般生长在25℃。3-8周龄幼、快速生长中植株释放活原生质体最多。Tal和Watts(1979)报道了生长于高相对湿度(82%)中的植株,原生质成活率增高。
在酶处理前,将叶肉组织放在渗透液中(预质壁分离),曾用于Lycopersicon种。我们发现能增高叶肉组织释放完整原生质体。单用甘露糖醇或含有甘露糖醇溶液,曾成功地用做预质壁分离溶液。
用于分离番茄叶肉原生质体的酶种类和浓度有所差异。早期报道说,用Driselase或Ma-cerozyme加入酶混合液,原生质体成活率降低。但是,在从原生质体植株再生报告中,曾用了这二种酶分离原生质体。许多学者在盐-糖溶液里加Meicelase,Macerozyme和Driselase组合以释放原生质体。一般言之,这样处理需在25-29℃暗培13-18小时。由于番茄原生质体松脆性质,采用静置而不是振荡培养。也由于如此,不适于用过滤法纯化原生质粗制品。将原生质体漂浮在糖溶液上,提供着较轻度和有效纯化方法。
因为培养的番茄原生质体的难处置性质,努力于设计使原生质体快速分裂的培养基。Zapata等(1977)改进的B5培养基曾普遍用于培养番茄原生质体。Zapata等(1977)采用这种培养基从L.peruvianum和Morgan和Cocking(1982)用番茄原生质再生了植株。其中盐类和维生素平衡有重要性。琼脂固化培养基与液体培养基都能适用。但是,栽培番茄原生质体再生是在琼脂培养基上取得的。
原生质体培养条件,包括开始时暗培1周,25-30℃,继之逐渐增高光强。Zapata等(1977)报道番茄和L.peruvianum原生质体培养在低于25℃时,不发生细胞分裂,最适温度为27-29℃。原生质体培养密度一般是0.5-2×105原生质体/ml。
植株生长条件、原生质体培养基和生长环境都对番茄叶肉原生质体稳定性和成活率有影响。原生质体生长条件的差异,要有利于其它种的再生。实际上即使一个种内如番茄,供试14个栽培品种中,只有Lukullus是在Morgan和Cocking(1982)所述条件下,从原生质体再生的。这就指出如果番茄原生质体能用于体细胞杂交研究,和把有用性状从野生种转移到栽培种中去,必需进一步改良目前的技术,使之适合于更多的番茄种和栽培品种。
(二)培养程序
1.愈伤组织培养 番茄种和品种的诱导愈伤组织遗传变异大,和其愈伤组织的染色体数很不稳定(非整倍体性和多倍体性)。还未找出分离和培养愈伤组织的共同程序。L.perμ-vianum的一些品种和L2番茄×L.peruvianum回交系含有25%番茄选系除外。
(1)外植体制备叶、茎切段和未开花芽(花药培养用)的消毒步骤,先在自来水细流中淋洗植株材料。再用稀去垢剂溶液轻度淋洗,除去污染物和土粒。组织和种子浸于70%乙醇中,随之立即用无菌蒸馏水淋洗。由于许多番茄种的叶,对乙醇很敏感,经常不用乙醇消毒。许多实验室完全不用乙醇,由于它对外植体组织在细胞培养体中反应有不良影响。然后将组织和种子放入5-10%商品漂白粉溶液中(约含0.25-0.5%次氯酸钠)。在漂白粉溶液中加几滴去垢剂溶液,以促使组织吸湿能力。消毒时间视组织的敏感性而定,5-15min。如用高度污染的种子,可放在20%商品漂白粉溶液15-20min。浸入无菌蒸馏水,换水2-3次。
常把叶切成5-10mm2小片,4边切开,使之充分暴露在培养基中。较粗茎段,剥去表皮和皮层,将髓组织切成厚约1mm的2-3mm小盘。
从花药取出花芽。一般将种子放在愈伤组织培养基中发芽,以提供无菌外植体材料。包括下胚轴、子叶、茎段和真叶。
(2)培养基 MS和B5为一般实验室所采用。其中以MS培养基最普遍。为了改进不同品种和种的生长,有几种改进的MS培养基。包括增加维生素浓度,不用甘氨酸,和加CW100-150ml或CH0.05-0.2%。Meredith(1978)也采用CS5培养基的矿质盐类,用以取得番茄品种“Marglobe”的最好生长。Chin等(1981)为了启动茎切段愈伤组织,采用了改进的White培养基。
视供试种和品种特点,选用荷尔蒙种类和浓度,举例于表22-4。在加琼脂前,调节培养基pH到5.5-6.0之间。所有培养基用高压蒸汽消毒。启动番茄和L2杂种的叶和种子愈伤组织的培养基和培养条件详细描述见胚培养。
表22-4 愈伤组织培养研究用的荷尔蒙
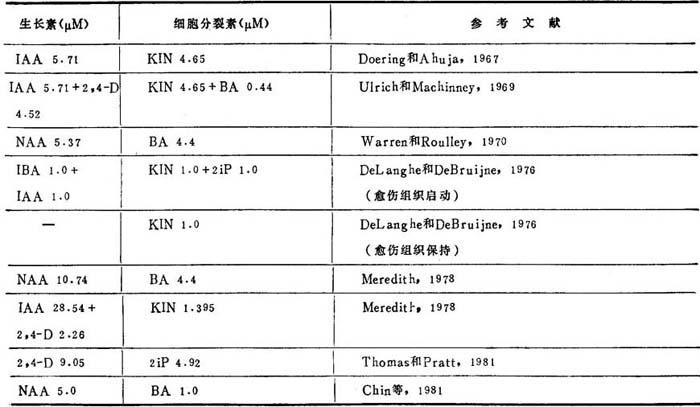
(3)培养条件 Evans等(1981)暗培以启动愈伤组织生长以抑制酚的氧化,或在培养基可附加500mg/l聚乙烯吡咯烷酮使酚分散在培养基中培养温度25-27℃。一旦可见愈伤组织增殖,每隔7-28天继代一次,视愈伤组织系生长率而定。
2.胚培养 Thomas和Pratt(1981)提出了下列技术,用胚愈伤组织培养产生杂种。
(1)外植体制备 授粉后30-40天收获果皮完整的果实,具体日数视母本果实发育速度而定。为了测定用于产生胚愈伤组织最有效时期,需在授粉后不同时期取样。果实放入95%乙醇中表面消毒,浸在5%次氯酸钠中5mim,用无菌蒸馏水充分淋洗。果实放在无菌吸水纸上,除去种子上的胶状复被。
(2)培养基 MS培养基盐类、蔗糖、肌醇、维生素和琼脂,附加硫胺素3.0μM。将盐类、维生素、肌醇和荷尔蒙溶液pH调节到6.0,分开高压蒸汽消毒。各别消毒蔗糖、琼脂和椰乳。然后将消毒的全部溶液混合。
用附加2,4-D9.05μM,2ip4.92μM和椰乳100ml/l的MS用做愈伤组织启动和保持培养基。愈伤组织培养基不加维生素盐酸吡哆醇和烟酸。芽再生培养基附加ZEA9.12μM,蔗糖浓度降到3-2%。生根培养基不加荷尔蒙,琼脂降到6g/l,除去肌醇,硫胺素,盐酸吡哆醇和烟酸。
(3)培养条件 愈伤组织培养体启动和保持,用暗培,27℃。愈伤组织应在2月内产生。当可见其生长时,应立即继代在新鲜培养基上。经2-3周后,把增殖的愈伤组织分成几小块,放在再生培养基上。芽再生和生根在室温(20-30℃),16h光周期,荧光下进行。每3周继代芽再生培养体一次。3个月内可取得芽,再过二周生根。
3.根培养
(1)外植体制备 幼小幼苗是用于启动根培养的取根的最好来源。取种子消毒,或无菌条件下,从无菌成熟果实取出种子。种子放在湿无菌滤纸上或Hoagland种子发芽琼脂上,在暗培中发芽。当根长到长1-3cm时,从幼苗上取根,放入液体培养基。从根丛中取长1-3cm根尖,用于每周继代。
(2)培养基 最常用White细胞培养,附加1-2%蔗糖,盐酸硫胺素,盐酸吡哆醇,烟酰胺,偶加甘氨酸;或改进的液体培养基。
(3)培养条件 根培养采取暗培,25-27℃。
4.芽培养
(1)外植体制备 番茄常用于芽再生的外植体是叶、茎、节间、下胚轴和子叶。处理程序同愈伤组织诱导。一般4-6周再生芽。
(2)培养基 芽培养最常用的基础培养基是MS,也曾用Gautheret培养基和LS培养基。曾用各种维生素含量和浓度,以B5培养基中的维生素成分最普遍。蔗糖浓度0.058-0.088M。培养番茄品种的植物荷尔蒙最适浓度和组合见表3,用于野生番茄种的见表22-4。常在不加生长调节剂的MS培养基上生根。如不生根,可附加IAA2.8-17.1μM。
(3)培养条件 外植体培养最常用温度24-27℃。光周期16h光照,荧光灯与白炽灯相配合,光强1000-10000lx。生长在生长箱里的培养体,常用相对湿度为50-70%。
5.花药培养 目前还没有产生单倍体愈伤组织和再生芽的普遍适用程序。部分由于基因型间和实验室间报道结果不同。
(1)外植体制备 曾采用单独或组合的各种浓度乙醇和次氯酸钙消毒番茄花芽。最常用的是轻取出花芽,放入70%乙醇10-20s,继而用0.25-7%次氯酸钙处理5-7min。再用无菌蒸馏水淋洗几次。从花芽中取出花药球果,仔细从其花丝末端分取各个花药。
(2)培养基 几种基础培养基曾用于诱导单倍体愈伤组织和芽(表22-3)。按照Levenko等(1977)所说,这些培养基中的矿质盐类都相等有效。有机附加物起着主要影响。荷尔蒙比率和浓度效果最显着。Gulshan和Sharma(1981)曾提出NAA+KIN对启动单倍体愈伤组织培养体可能是关键。没有找出只产生单倍体芽的荷尔蒙组合。Zamir等(1980)和Ziv等(1982)报道用IAA+ZEA取得了二倍体或双单倍体,或用2,4-D+NAA+BA+KIN的组合。
(3)培养条件 花药常培养在人工光照2000-20000lx下,光周期12/12或16/8h。生长温度或是常温25或27℃,或是室温24-32℃。培养体保持在相对湿度70%的生长箱里。
6.原生质体
(1)原生质体制备
①番茄品种Lukullus种子播种在无土堆肥中,生长在16h光照下,光强7000lx。
②从3-4周龄植株上取第一片真叶,用8%(v/v)Domestos表面消毒25min,无菌蒸馏水淋洗5次。
③除去叶下表皮,撕面向下浮在质壁分离溶液中1h:KH2FO4 0.19mM,KNO31mM,CaCl2·2H2O 10.1mM,MgSO4·7H2O 1mM,KI0.96μM,CuSO4·5H2O 0.1μM(CPW盐类),甘露糖醇0.5M,pH5.7。
④用过滤消毒的酶溶液代替质壁分离溶液。酶溶液组成是Meicelase P1.5%,Driselase0.16%,Macerozyme 0.15%,溶于CPW盐类中,甘露糖醇0.49M,pH5.7,和抗生素混合液:ampicillin1.1mM,四环素0.02mM,gentaruycin 10mg/l和rifampicin 0.06mM。培养在13h黑暗,27℃。
⑤轻挤叶小片,释放原生质体。
⑥将粗制原生质体离心100×g4min。
⑦将片状沉积的原生质体再悬浮在CPW盐溶液中,加有蔗糖0.6M。离心120×g8min。
⑧吸取上浮的原生质体,再悬浮在改进的B5培养基中,达到密度1×105/ml。
(2)培养条件
①取1.5ml原生质体悬浮体与等体积的温暖原生质体培养基相混合,培养基加有1%琼脂,放在5cm培养皿中。用石蜡膜,暗培在30℃,7天。
②暗培7天后,将植板体移至光强800lx中,27℃。
③28天后,再生成细胞小克隆。于是每隔2周,降低甘露糖醇浓度,将带有克隆的琼脂块移到含有甘露糖醇0.33M的固体培养基上,继之用甘露糖醇0.16M的培养基。
④然后将原生质体产生的愈伤组织移到芽再生培养基上,含有MS盐类和维生素,蔗糖0.058M,琼脂0.8%和ZEA 4.6μM(MSZ)。
⑤每月继代愈伤组织到新鲜MSZ培养基上,直至再生植株,生长至4cm高。
⑥再生植株继代在MS琼脂培养基+NAA 0.54μM,使之生根。
(三)展望
番茄细胞培养应用于育种前,要克服几种困难:建立染色体数稳定的细胞悬浮培养体,控制细胞培养植株再生,从游离原生质体取得植物,或从花药培养产生单倍体。无论如何,番茄有若干特性值得深入研究。这是重要商品作物,具有良好遗传体系,古代相对较短。最近用血缘密切的野生番茄种,取得原生质再生成功,以及VFNT品种长期细胞培养再生,是鼓舞人心的。
为了若干细胞遗传研究,建立染色体稳定的细胞悬浮培养体有重要性。番茄细胞培养体建成后,很快增高染色体不稳定性。若干学者曾报导过不稳定多倍体和非整倍体细胞培养体。一旦建成稳定(细胞)系,应经常继代,以保证反常细胞群体不断稀释。稳定细胞系应保持植株再生能力。这种特征对突变体分离和原生质体融合很有用。采用已有细胞系选择农业有价值性状的那些变异体,已不能再生植株(参考Meredith,1978)。稳定的细胞系还能用于测试次生代谢产物。栽培番茄或野生种悬浮培养体能用以生产几种化合物。例如,L.hirsutum生产的自然杀虫剂,2-tridecanone。稳定的愈伤组织或细胞悬浮培养体也能用于病理研究。就其它种言,曾用愈伤组织筛选真菌病原菌抗性。能再生植株的细胞系,也能用于选择病原菌培养体过滤物或特种毒物抗性。
长期培养体再生植株可能用于取得变异体或无性系。如上所述,染色体稳定的细胞悬浮培养体,对产生新变异体,以供育种应用。这样,能用诱变作用或体细胞变异以鉴别新奇变异体。另一方面,植株再生能用以无性系繁殖某些基因型。例如,采用茎尖繁殖可克隆温室生产的杂种番茄。同样,生产杂种种子的雄性不育亲本植株,可用离体培育繁殖。
原生质体再生将为遗传修饰单个细胞,和取得完整植株。两个种的原生质体能融合产生新奇杂种。几种异种间组合可用于育种方案。大多数野生种带有有益性状,如果与栽培番茄整合的话,如L.cheesmanii的耐盐性,或L.hirsutum的耐寒性。
花药培养产生单倍体已有报道,但分离和产生栽培番茄单倍体植株还未见到。未来目标是产生单倍体细胞系,它能在离体培养下长期保存和操作,保持再生单倍体,双单倍体能力,或在融合试验中,产生杂种二倍体植株。由于难于证实二倍体或较高倍数性植株的来源,花药培养的供试品系,应引入遗传标记基因。由于番茄已有若干遗传品系,这是易于做到的。Zamir等(1981)曾设想用同工酶标记,作为鉴别单倍体再生植株的有利方法。因为同工酶的互显性表达,易于从每个同源单倍体类型中分出杂合体。单倍体特别适用于从培养的细胞分离隐性突变,以及取得2n=24染色体的体细胞杂种。
【参考文献】:
〔1〕Arbeitskreis Spargelbau in Suedwestdeutschland 1974 Ingelheim-Geisenhelm(H.D.Hartmann,ed.)Annual Report.
〔2〕Asparagus Research 1980-1981 Vegetable Crops Series;Dept.of Vegetable Craps,Univ.of California,Davis,Annual Report.
〔3〕Hung,L.1975Annotated Bibliography on Asparagus,p.547.Publ.by Depart-ment of Horticulture,National Taiwan Univ.,Taipei,Taiwan,People′s Rep-ublic of China.
〔4〕Reuther,G。ed.1979 Proceedings of the 8th International Asparagus Symp-osum,314pp.Eacarpia Section Vegetables,1979 Geisenhelm,Geisenhelm Forsc-hungsanstalt,GermanY.
〔5〕Thevenin,L.ed.1973 4eme Reunion sur la Selection de l′asparage,Eucarpia Section Horticole,VersailIes.
〔6〕Ammirato,P.V.1983 Embryogenesis In:Handbook of Plant Cell Culture Vol,1.(D.A.Evans,W.R.Sharp,P.V.Ammirafo and Y.Yamada eds.)pp.82-128 Macmillan,New York.
〔7〕Evans,D.A.1983 Proloplast fusion In:Handbook of Plant Cell Culture Vol.1(D.A.Evans,W.R.Sharp,P.V.Ammirato and Y.Yamada eds.)pp.291-324,Macmillan,New York.
〔8〕Evans,D.A.and J.E.Bravo 1983 Protoplast isolution and culture.In:Handbook of Plant Cell Culture Vol.1(D.A.Evans,W.R.Sharp,P.V.Aminirato and Y.Yamada eds.)pp.124-176.Macmillan,New York.
〔9〕Flick,C-E.1983 Isolation of mutants from cell culture.In:Handbook of Plant Cell Culture Vol.1(D.A.Evans,W.R.Sharp,P.V.Ammirato and Y.Yamada eds.)pp.393-441 Macmillan New York.
〔10〕Peterson,C.E.and P.W.Simon Carrot Breeding.In: Breeding Vegetable Crops(M.J.Basset ed.)AVI Publishing,Westport,Conn.(In Press)
〔11〕Sung,Z.R.and D.Dudits 1981 Carrot Somatic cell genetics.In:Genetics Engineering in the Plant Sciences.(N.J.Panopoulos ed.)pp.11-37,Praeger,New York.
〔12〕Evans,D.A.and W.R.Sharp 1983 Single gene mutations in tomato plants regenerated from tissue culture.Science 22I∶949-951.
〔13〕Kartha,K.K.,O.L.Gamborg,J.P.Shyluk and F.Constabel 1976.Mor.phogenetic investigations on in vitro leafe culture of tomato(Lycopersicum escul-entum Mill.cv.Starfire)and high fregueney plant regeneration.Z.Pflanzenphysiol.77∶292-301.
〔14〕Kut,S.A.and D.A.Evans 1982 plant regeneration from cultured leaf explants of eight wild tamato species andtwo related Sdanum Species.In Vitro 18∶593-598.
〔15〕Morgan,A.and E.C.Cocking 1982 plant regeneration from protoplasts of Lycopersicum esculenfum Mill.Z.P Planzenphysiol.106∶97-104.
〔16〕Thomas,B.R.and D.Pratt 1981 Breeding tomato strains for use in cell culture resea rch.PMB Newsletter 2∶102-105.
〔17〕Ziv,M.,D.Hadary,and N.Kedar 1982 Dihaploid plants regenerated from tomato anther in vitro.In:Proc.Fifth Intem.Congress on Plant Tissue Culture.
〔18〕Bhatt,D.P.andG.Fassuliotis 1981 plant regeneration from mesopluyll protoplasts of eggplant.Z.pflanzenphysiol.104∶81-89.
〔19〕Gleddie,S.,W.A.Keller and G.Setterfield 1983 Somatic embryogenesis and plant regeneration from leaf explants and cell suspension of Solanum melongena(eggplant).Can.J.Bot.61:656-666.