克分子、克当量、当量浓度等与物质的量、物质的量浓度换算关系
出处:按学科分类—工业技术 中国轻工业出版社《皮革工业手册制革分册》第769页(2751字)
1.克原子、克分子、克离子、克当量与物质的量的关系
物质的量为基本量之一。以前使用的克原子、克分子、克离子、克当量等单位名称都应废除,只要将相应的基本单元指明(原子、分子、离子、电子及其它粒子,或是这些粒子的特定组合),这些单位都应用摩尔代替。
例如:1克原子Ar 应改为1mol Ar
1克分子H2SO4 应改为1mol H2SO4
1克离子H+ 应改为1mol H+
在涉及物质的量n时,如用式子表示单元较为简单、明确,在式子中,基本单元的符号在符号n齐线的圆括号中,例如:n(S)=28mol,n(Ca2+)=2mmol,n(MnO4)=40mol
2.当量浓度与物质的量浓度的关系
当量浓度为非法定计量单位,应予以废除,改用物质的量浓度。将当量浓度换成物质的量浓度(mol/L),应弄清有关化学的本来概念,只有弄清楚原来用“N”时所指的基本单元后,才可以用mol/L代替而数值不变。也就是要看原来所指的克当量是该克分子的多少分之一。
例如:H2SO4的克当量(49.09g),通常是它的克分子(98.08g)的 ,那么其基本单元也就是
,那么其基本单元也就是 。这说明将物质的基本单元改变后,所计算出来的物质的量浓度数值就和当量浓度的数值相同。据此物质的量浓度c(B)改用c(1/zB)形式表示,物质的量浓度可以很方便地代替当量浓度NB,即NB=c(1/zB)式中z为化学价数或得失电子数。
。这说明将物质的基本单元改变后,所计算出来的物质的量浓度数值就和当量浓度的数值相同。据此物质的量浓度c(B)改用c(1/zB)形式表示,物质的量浓度可以很方便地代替当量浓度NB,即NB=c(1/zB)式中z为化学价数或得失电子数。
例如:1NH2SO4=1mol/L( )
)
1NBa(OH)2=1mol/L(1/2Ba(OH)2)
1NKMnO4=1mol/L(1/5KMnO4)(H+性)
1NKMnO4=1mol/L(1/3KMnO4)(OH-性)
1NK2Cr2O7=1mol/L(1/6K2Cr2O7)(H+性)
如果不改变基本单元,而用物质的基本单元,即用c(B)表示时,也可以代替当量浓度。换算方法是直接用当量浓度的数值除以物质在化学反应中表现出的化学价(或得失电子数目),即:
物质的量浓度=当量浓度/给出(结合)H+的数目
物质的量浓度=当量浓度/得(失)电子的数目
物质的量浓度=当量浓度/化合价变化
例如: (给出2个H+)
(给出2个H+)
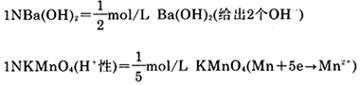
在酸碱滴定中,以NaOH或HCl作为基本单元;
在氧化还原滴定中:高锰酸钾法以1/5KMnO4作为基本单元,重铬酸钾法以1/6K2Cr2O7为基本单元,碘量法以Na2S2O3为基本单元。
3.质量体积百分浓度与质量浓度的关系
对于溶质为固体的一般溶液,过去习惯用质量体积百分浓度(m/V)表示,是不对的,应改为质量浓度单位,如g/mL,g/L等。
例如:30%NaCl溶液,它是指100mLNaCl溶液中含有30gNaCl,应表示为300g/L或0.3g/mL。
4.水的硬度单位换算系数
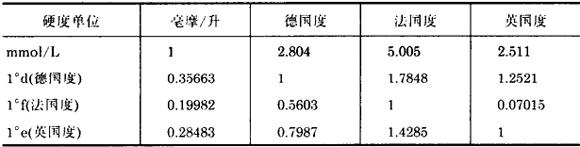
水质硬度单位如不是以“mmol/L”为单位的,均按上表关系换算为“mmol/L”。
5.废除“当量浓度”后,容量分析计算实例
在分析化学的容量分析中,以前把当量、当量定律作为分析计算的依据,即在容量分析中,用NAVA=NBVB(NA、NB分别代表反应物A和B的当量浓度,而VA、VB分别代表反应物A和B的溶液的体积)来进行计算。
例题1 设用了40.00mL当量浓度为0.200N的硫酸恰好中和50.00mL的氢氧化钠,求氢氧化钠的当量浓度。
解 根据当量定律:

“当量浓度”是非法定计量单位,现已由SI单位中的“物质的量浓度”(或称“浓度”)所取代。在采用物质的量浓度后,在酸碱滴定中就用等物质的量反应规则代替当量定律,即用:c酸V酸=c碱V碱代替N酸V酸=N碱V碱
物质的量浓度SI单位为mol/m3,常用mol/dm3或mol/L。
由于物质的量浓度的单位中用了摩尔,因此必须指出参加中和反应的基本单元(即化学式)。现要对例题1用物质的量反应规则进行运算,则应将例题1改为例题2。
例题2 设用了40.00mL浓度为0.200mol/L的 ,恰好中和50.00mL的NaOH,求NaOH的浓度c(NaOH)。
,恰好中和50.00mL的NaOH,求NaOH的浓度c(NaOH)。
解 已知 ;V(NaOH)=50.00mL
;V(NaOH)=50.00mL
根据等物质的量反应规则:

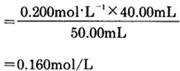
按例题2的说明,其中和反应式为:
