烧碱法蒸煮液的分析计算
出处:按学科分类—工业技术 中国轻工业出版社《制浆造纸工业计算手册下册》第227页(2020字)
1.总碱量的测定计算
[说明]总碱量指蒸煮液中全部碱的含量。烧碱法蒸煮液的总碱量包括NaOH+Na2CO3的量,常用Na2O表示。
[测定方法]在500mL容量瓶中,倾入200mL左右新经煮沸并已冷却的蒸馏水,再用移液管吸取25mL碱法蒸煮液放入容量瓶中,然后加水稀释至刻度,摇匀。用移液管吸取上述样品50mL于300mL锥形瓶中,加入1~2滴甲基橙指示剂,以0.5M盐酸标准溶液滴定至橙红色为止。

式中 G-总碱量(g/L)(以Na2O计)
V-滴定耗用盐酸量(mL)
M-盐酸标准溶液的摩尔浓度(mol/L)
0.031-与1mL1mol盐酸溶液相当的氧化钠的量(g)
2.活性碱量的测定计算
[说明]活性碱量是指烧碱法蒸煮液中全部氢氧化钠的含量。
[测定方法]取一500mL容量瓶,预先注入新煮沸并已冷却的蒸馏水至半满,用移液管加入25mL试样,再加入10%BaC12溶液至沉淀完全(待沉淀物下沉后,用清洁玻棒沾此溶液,滴入盛有稀硫酸的试管中试之,如无白色沉淀,则应再加BaC12溶液,直至得到白色沉淀为止),并有微过量BaC12存在为止。最后加水稀释至刻度,摇匀;静置以使碳酸钡沉淀下降。用移液管吸取50mL上层清液于300mL锥形瓶中,加入1~2滴甲基橙指示剂,用0.5M盐酸标准溶液滴定至橙红色。

式中 G1-活性碱量(g/L)(以NaOH计)
V-滴定耗用的盐酸标准溶液量(mL)
M-盐酸标准溶液的摩尔浓度(mol/L)
0.040-与1mL1mol盐酸溶液相当的氢氧化钠的量(g)
3.碳酸钠含量的测定计算
[说明]可由已测得的总碱量减去活性碱量而求得。
[公式] G2=1.709G-1.325G1 (3-1-10)
式中 G2-碳酸钠含量(g/L)(以Na2CO3计)
G-同式3-1-8
G1-同式3-1-9
1.709-Na2O转换成Na2CO3的系数
1.325-NaOH转换成Na2CO3的系数
4.“双指示剂”法测定总碱量、活性碱量和碳酸钠量的计算
[说明]“双指示剂”法可以同时一次测定出总碱量、活性碱量和碳酸钠的含量,此法准确性稍差,但方法简单快捷,如对测定结果不要求特别精确的情况下可以采用;亦可采用此法作为控制生产之用。
[测定方法]在500mL容量瓶中,倾入200mL左右新经煮沸并已冷却的蒸馏水,再用移液管吸取25mL碱法蒸煮液放入容量瓶中,然后加水稀释至刻度,摇匀。用移液管吸取50mL上述溶液于300mL锥形瓶中,加入2~3滴酚酞指示剂,以0.5M盐酸标准溶液滴定至由红色变为无色,记录下所用去的盐酸的体积V1;再加入2~3滴甲基橙指示剂,继续用0.5M盐酸标准溶液滴定至由黄色变为橙红色,记录下此阶段所用去盐酸的体积V2。
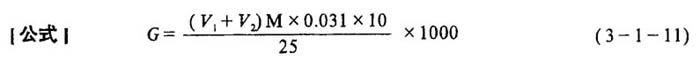
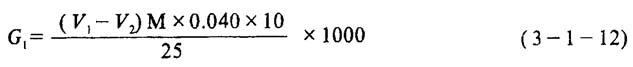

式中 G、G1、G2-分别为蒸煮液的总碱量(Na2O计)、活性碱量(NaOH计)和碳酸钠量(Na2CO3计)(g/L)
V1-用酚酞作指示剂时耗用的盐酸溶液的体积(mL)
V2-用甲基橙作指示剂时耗用盐酸溶液的体积(mL)
0.053-与1mL1mol盐酸溶液相当的碳酸钠的量(g)
其它同上