海藻 甘草
出处:按学科分类—医药、卫生 军事医学科学出版社《对药的化学、药理与临床》第1026页(19489字)
【中医理论】
海藻甘草同用于一方,首载陈实功《外科正宗》海藻玉壶汤。用于瘰疠,瘿病,乳癖等症。
【药理研究】
1.对肝药酶的影响[1]
动物按所给药物分不同的药物组和对照组。灌胃给药,每天1次,连续3d,禁食20h,处死,取肝脏,拈去血液,称肝重。用0.25M蔗糖Tri8-HCL缓冲液制成匀浆,浓度为200mg/ml,纱布过滤后,用含150mMKCl、10mMMgCl2的50mMTris-HCL缓冲液稀释至20mg/ml,通以CO,5min后,将样品移入样品杯和参照杯,静置3min,再向样品杯中加入Na2S2O45mg,混匀,静置2min后在分光光度计上以参照杯为空白管,测量波长为450nm和490nm时的光密度值,计算肝匀浆中细胞色素P-450含量。
甘草、海藻对小鼠肝药酶的影响:给药小鼠随机分为甘草Ⅰ组(6.6g/kg)、Ⅱ组(26.4g/kg),海藻Ⅰ组(6.6g/kg)、Ⅱ组(26.4g/kg)。结果见表16-1-1。
表16-1-1 甘草、海藻对小鼠肝匀浆细胞色素P-450含量的影响

注:与对照组比:* *P<0.01
动物胃饲甘草煎剂后,两个剂量组肝匀浆细胞色素P-450含量均显着增高,与对照组比较P<0.01。海藻各剂量组的细胞色素P-450含量变化不明显(P>0.05)。表明甘草有诱导肝药酶的作用。
甘草配海藻合煎剂对小鼠肝药酶的影响:给药组动物随机分为合煎Ⅰ组(甘草∶海藻为1∶1)、合煎Ⅱ组(甘草∶海藻为3∶1)、合煎Ⅲ组(甘草∶海藻为1∶3),各组给药剂量均为13.2g/kg。结果见表16-1-2。
表16-1-2 甘草、海藻合煎剂对小鼠肝匀浆细胞色素P-450含量的影响

注:与对照组比:*P<0.05,* *P<0.01。
甘草与海藻合煎后,随着伍用比例的不同,小鼠肝匀浆细胞色素P-450含量也不同,其中合煎Ⅰ组与对照组比无显着性差异(P>0.05),合煎Ⅱ组和合煎Ⅲ组与对照组比均有显着提高(P<0.05和P<0.01)。
甘草、海藻分煎合剂对小鼠药肝酶的影响:给药组动物随机分为分煎合剂Ⅰ组(甘草∶海藻为1∶1)、分煎合剂Ⅱ组(甘草∶海藻为3∶1)、分煎合剂Ⅲ组(甘草∶海藻为1∶3)。结果见表16-1-3。
表16-1-3 甘草、海藻分煎合剂对小鼠肝匀浆细胞色素P-450含量的影响

甘草与海藻分煎合用后,所设三个配伍比例组动物肝匀浆细胞色素P-450含量与对照组比均无显着性差异(P>0.05)。
肝药酶,即肝细胞微粒体中细胞色素P-450系统,是肝脏代谢药物的关键酶,本研究证实:甘草与海藻以一定比例混煎后具有诱导肝药酶的作用,二者分煎合用对肝药酶无明显影响。
2.对急性肝损伤家兔的影响[3]
所用生药(单味组分煎,配伍组将生药按比例混合后再煎)均加水淹过药面,在室温20~22℃浸泡12h后煮30min,用双层纱布过滤,两次滤液混合,浓缩成每毫升含1g生药,冰箱保存备用。两组均以7g/kg体重计,对照组灌同体积普通水。
选当年家用肉兔,观察7d,然后从耳缘静脉采血作血清谷丙转氨酶(SALT)测定,选SALT值在92U以下;组间平均体温38.3℃±0.5℃~38.9℃±0.55℃;体重平均1.17~1.22kg;精神,食欲,饮水,粪尿均正常者为实验对象。根据实验要求,将68只家用肉兔随机分为10组(病理6组,生理4组),病理组每组8只,生理组每组5只,病理组将四氯化碳(CCL4)石蜡油等量混合澄清灭菌液,按体重每公斤0.6ml于两股内侧皮下注射,制造急性肝损伤模型;注射后于第24h与72h分别采血,检查SALT,造模期每天测量体温,48h称重,第72h采血,称重后按体重计量,用小胃管一次灌药;于灌药后24h、48与72h分别采血,检查SALT,并测量体温,观察精神,饮食和粪尿等变化,生理组于称重、采血后即灌药;两组于灌药72h后耳静脉注入空气致死,称重,尸检,并取材制作切片检查。每天早晚测量体温,观察精神,粪尿的变化;称量体重,血清SALT测定-懒氏法;病理检查,尸检用肉眼观察心、肝、脾、肺、肾、膀胱、胃、十二指肠、空肠、肠系膜淋巴结、圆小囊等有无变化,并分别取以上脏器组织块,10%甲醛固定,石蜡切片,HE染色,光镜检查。
结果:于服药后2~72h,病理与生理各组(包括对照组)精神,食欲均正常,从饮水量看,病理组于药后2~6h除对照组饮水正常(90ml/3只)外,其余各组均未饮水,药后8h各组饮水量恢复正常,而生理组于药后2~4h,单味甘草组未饮水,单味海藻组饮水量增加(200ml/只),6h后各组饮食恢复正常。从粪尿的情况看,无论生理或病理各组在服药后不同时间内,均无明显变化。体温、体重各组药前、药后也无差异。
SALT检查,病理组SALT检查组间无差异性,在组内药前、药后不同间隔时间(24、48、72h)非配对t检验亦无差异性。但从递减(24h与药前比,48h与24h比,72h与48h比)百分率来看,无论是对照组、单味组以及配伍组均呈下降趋势,以单味海藻组、配伍1∶1组于药后24h下降最多,分别为64.18%、58.36%,见表16-1-4。生理组药前、药后和不同间隔时间SALT,组间无差异性。组内非配对t检验亦无差异性,从递减百分率来看,各组于药后24、72h均呈上升趋势,以单味海藻组于药后72hSALT上升最多,为66.61%,结果见16-1-5。
表16-1-4 病理组SALT值非配对t检验表

*“-”表示下降,“+”表示上升
表16-1-5 生理组SALT值非配对t检验表

*“-”表示下降,“+”表示上升
病理变化:肉眼观察:两组实验兔(病理组22只,生理组12只)于服药后72h人工致死,对胸腹腔及各脏器进行详细检查,两组共剖检34只,其胃内均充满食物,胃肠道粘无眼观变化;病理组的单味甘草组及甘草、海藻2∶1组多数兔腹腔有较多的清亮液体,肝颜色暗红,肝小叶比较明显;单味海藻组肝微肿大,色暗红或灰黄色;其他各组实质脏器均无明显的眼观变化。镜检:实验兔(除生理对照组)均查到了程度不同的病理变化,其中以肝肾变化较为明显。肝主要表现为颗粒变性及小叶中心性坏死;肾主要表现为充血。这两个脏器变化以两组中的单味海藻组较为明显。说明海藻本身对肝肾结构有一定程度的损伤作用。配伍后各组的镜检变化均不明显。
3.对甲状腺激素及其抗体的影响[3]
海藻与生甘草(1∶0.5)置同一砂锅中加水浸60min,每次煮沸40~50min,两次滤液合并后水浴浓缩。健康豚鼠体重、性别和毛色随机分成四组,每日给海藻每公斤体重30g,生甘草按比例。其水煎剂分早晚2次拌入限量饲料中(以不剩余为度),午间未加药的饲料供充分,蔬菜以甘蓝叶为主。空白组拌入等容积水。饲养30d后,每日上午8~9时各实验组穿插断头取血,放射免疫法测定血清中三碘甲状腺原氨酸(T3)、四碘甲状腺原氨酸(T4)、促甲状腺激素(TSH)、甲状腺微粒抗体(TMA)和甲状腺腺球蛋白抗体(TGA)。
饲养30d内,其精神、毛色和粪便(仅染成煎剂色)如常,不影响体重增长和求偶发情,更无1例死亡。
表16-1-6 对甲状腺激素及其抗体含量的影响( )
)

表16-1-7 甲状腺激素及其抗体处理组间秩和检验

海藻及配伍组主要升高T4,而对T3及TSH影响不大。海藻和生甘草均有不同程度降低TMA和TGA作用,配伍后降低TMA和TGA幅度最大,尤其是TMA。
4.家鸽呕吐试验
每组家鸽五只,分别灌胃水煎剂,1ml各含100%海藻生甘草、海藻炙甘草和100%海藻,60min内均未出现呕吐。
5.对小鼠耐高温能力的影响[4]
实验分两部分:分别用老年鼠和初成年鼠,各分对照与造型两大组,同期在相同条件下饲养,对照组给水,造型组给同容积的甲状腺粉混悬液,每日1次,连续3d或4d,各大组又分对照(给水)、海藻、甘草以及二药混合液组,药液容积相同,给药3h左右按组置入高温室内,记录死亡时间,计算存活时间,以停止呼吸、不再运动为主要死亡指标,眼球色淡,尾紫绀为辅助指标。
高温室系自动改装,以恒温箱与液晶显示数字体温计联合,探头在鼠笼上方1cm左右,温度显示灵敏度0.1℃,温箱有玻璃门,外加照明,可以直接观察小鼠活动情况,记录死亡时间,以min为单位,实际温度控制在50℃左右。老年小鼠灌胃给予甘草、海藻后的耐高温试验:用老年小鼠给甲状腺粉3d后测定结果,见表16-1-8。
表16-1-8 老年甲亢小鼠灌胃给予甘草及海藻后耐高温试验

与1-4(5)比较:*P<0.05,* *P<0.001;与1-5(5)比较:# #P<0.01;与1-1(5)比较:▲▲P<0.01,与1-8(5)比较:△△P<0.01
初成年小鼠灌胃给予甘草、海藻后,耐高温试验:用初成年小鼠给甲状腺粉4d后,测定结果见表16-1-9。
表16-1-9 初成年甲亢小鼠灌胃给予甘草及海藻后耐高温试验

与2-4(5)比较:* *P<0.01;与2-5(5)比较:# #P<0.01;与2-1(5)比较:▲▲P<0.01;与2-8(5)比较:△△P<0.01
【毒理研究】
1.单味及配伍的急性毒性试验
报道1[5]
实验分组:水浸煎剂:海藻、甘草浸泡,加水煎煮两遍,过滤,浓缩至1ml相当于生药1g。煎剂:未经浸泡。加水煎煮两遍,过滤。滤液浓缩至1ml相当于生药2g。等量复合配伍共煎剂:分别将藻、戟、遂、芫、甘草各5g,加水同煎两遍,过滤,滤液浓缩至1ml相当于生药2g。剂量:根据小鼠及家兔预试验结果选用中等安全量,对照组设冷开水与甘草组两种。
试验观察:口服结果:小鼠两种剂型单味与配伍口服后连续观察精神、饮食、粪便72h。其中除水浸煎剂甘遂、甘草组0.3+0.3g服药后16h死亡2只,剖检见小肠水肿外,其他均无外观反应,等量配伍共煎剂,分3组给小鼠每只口服给药1.2g后,连续观察72h无反应,家兔灌药(水浸煎剂)后分别在5、24、48h观察。单味组与配伍组其体温、精神、饮食、粪便均正常。与健康对照组相比无明显变化。腹腔注射结果:同一制剂(水浸煎剂)给小鼠腹腔注射,配伍组比单味组毒性增强。见表16-1-10。家兔未作腹腔注射。
表16-1-10 单味或配伍给小鼠服腔注射实验结果

*每种0.1ml为一个剂量组,每组注射8只,剂型为水浸煎剂。
实验室检查:预实验表明,家兔口服药物后4~5h即可从尿中排出药液成分。因此,我们在家兔投药后5h从心脏采血进行血液学及生化指标检查,结果见表16-1-11。在12项指标中,白细胞,血糖,胡萝卜素各组均无变化。胆红素、黄疸指数、硫酸锌浊度、麝香草酚浊度、无机磷等变化亦不明显。在3项指标计24个项目中(谷丙转氨用赖氏法),7项表现差异显着(P<0.05),7项表现差异非常显着(P<0.01)
表16-1-11 各组家兔部分生化指标统计结果( )
)

()内数字为动物数:与对照组比较:*P<0.05,* *P<0.01;与单味组比:△P<0.05
病理变化:眼观:小鼠口服药物后均正常;腹腔注射后24h内小鼠全部死亡。剖检:海藻、甘草组除有小肠充血、水肿外,其余两组均无眼观变化。家兔灌药后一定时间(5、24、48h)击脑致死,共剖检260例,单味组与配伍组24h部分病例小肠充血,48h小肠充血不明显。胃粘膜仅大戟、甘草配伍组24h有轻度脱落外,其他单味组与配伍组均无变化,实质器官也无明显变化。粪便潜血除海藻、甘草组(20/30)阳性外,其余均阴性。
镜检:单味海藻组与海藻甘草组:胃肠道有些充血,个别病例出血、水肿,肝肾颗粒变性。
单味甘草及其配伍给健康小鼠口服后,连续观察72h,除甘遂、甘草配伍组于服药后16h死亡2/16外,其余精神、食欲、粪便均正常;而同一剂型腹腔注射则毒性大大增强。单味甘草及配伍,用中等安全量给260只家兔(其中60只进行组织学检查)灌服,于药后5、24、48h,其体、精神、饮食、粪便等未见异常变化,而且单味组与配伍组之间亦无明显差异,说明用药后对动物刺激作用较强,不足以引起临床反应,但有些血液生化指标有显着差异,同时在眼观及镜检上,除个别单味组和配伍组外,多能看到基本相同的病理变化,这些变化都不严重,经过较短时间是可以恢复的,因此,可以认为上述药物的单味和配伍在本次实验中未引起严重的眼观和镜下炎症变化。通过和对照组比较,可以看出海藻药物本身仍具有一定刺激作用。单味组和配伍组的血液生化指标与病理变化基本相符。单味组与配伍组在病理变化的性质上也没有显着差异,但在程度上有一些区别。实验结果表明:甘草组各味分别制成煎剂再配伍后给小鼠腹腔注射,其毒性和刺激性都很强,而口服无眼观变化。给家兔口服后其反应不一致。因此。从家兔的实验提示我们,在反药的配伍应用上不应把“藻、戟、遂、芫俱战草”绝对化而一概肯定或否定,应具体分析。
报道2[6]
采用水浸煎剂,即将海藻、甘草于容器内加5~7倍水浸泡12h(过夜),煎煮30min,过滤,再加水煮沸30min,过滤,滤液合并,以电热恒温水浴,浓缩至每ml相当生药1g或2g,冰箱保存备用。本次实验所用制剂除甘遂与甘草不同比例采用水浸合煎外,其余制剂采用水浸分煎。采用单味海藻、甘草的水煎剂,以海藻配甘草,按1∶1、1∶2、2∶1配伍后合煎成三种制剂,再加三种单味煎剂共九种制剂。每种制剂随机选用5组小鼠,每组10只,分别腹腔注射,观察72h,记录死亡数,以简化寇氏法计算LD50,按合并用药效应公式计算配伍组的预期LD50(1/预期LD50=a/(A)LD50+b(B)LD50要求a+b=1),再以预期LD50的比值(K)判定配伍组动物的合并效应。公式规定比值(K)大于0.4,比值在0.4~2.5之间表示合并效应增强;若比值(K)小于0.4表明合并效应减弱。
药物对急性肝损伤小鼠的毒性作用试验:选健康小鼠,体重16~24g,在雌雄不分,随机分组,每组10只,以每公斤体重皮下注射4%四氯化碳石蜡油注射液5ml(即0.2g/kg体重,于注射后24h分别腹腔注射各种制剂,药物剂量以健康小鼠测得的LD50量,然后观察72h,记录死亡数,计算存活率。
小鼠口服单味甘草、甘遂、海藻及甘草配伍海藻、甘遂不同比例制剂的毒性用于试验,见表16-1-12。口服后经48~72h观察,一般无明显毒性作用,停药后短时间即可恢复正常。
表16-1-12 小鼠口服单味及甘草与各药不同比例配伍的毒性试验

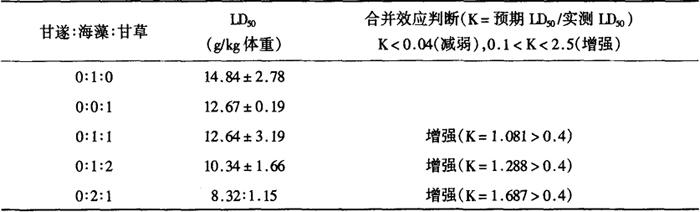
LD50测定:单味海藻、甘草及海藻分别配伍甘草的1∶1、1∶2、2∶1制剂的LD50及配伍组药物合并效应的判断,见表16-1-13。
表16-1-13 甘遂、海藻与甘草的单味及其不同比例配伍LD50及合并效应判断
病理模型小鼠对单味各药及其不同比例配伍LD50的反应值间差异显着性检验,见表16-1-14。
表16-1-14 单味甘草、海藻、甘遂及配伍组LD50对病理模型小鼠的毒性反应

急性肝损伤小鼠病理模型制造:给小鼠以每公斤体重皮下注射4%四氯化碳石蜡油注射5ml,于注射后24、48、72、96h断头取血,测定血清谷丙转氨酶(SALT),并取肝组织作切片镜检,其结果见表16-1-15。
表16-1-15 小鼠急性肝损伤病理模型的病变

从表16-1-15结果表明:小鼠口服单味甘草、海藻及其分别与甘草的不同比例配伍,当各剂量达到每公斤体重40g以上时无一死亡,同时也无明显毒性反应,表明口服以上药物不能测得LD50,亦说明海藻与甘遂分别与甘草以1∶1、1∶2、2∶1的比例配伍后,口服无“反”迹象。根据腹腔注射测定LD50结果及合并用药效应公式的计算结果对配伍用药后的合并效应判断。海藻与甘草1∶1、1∶2、2∶1配伍组的预期LD50与实测LD50的比值(K),分别为1.081、1.288、1.687,均在0.4与2.5之间,表明以上三种比例合并应用毒作用增强,有“反”作用。
小鼠急性肝损伤后24h,每组10~20只腹腔注射单味甘草、海藻及其不同比例LD50,对急性肝损伤小鼠致死率均在50%以上,表明对急性肝损伤小鼠毒性更强;其中唯有海藻配伍甘草1∶2组引起小鼠死亡率为40%,但与单味引起死亡比较,经生物统计处理差异不显着(P>0.05),说明与单味的毒性作用无明显区别。对急性肝损伤毒性增强,说明肝脏解毒能力减弱,也说明腹腔注射无论是单味甘草、甘遂、海藻以及不同比例的配伍均对肝病不利。
小鼠口服单味甘草、海藻以及口服甘草分别与海藻的不同比例的配伍制剂,在超治疗量的若干倍无毒性症状,也无一死亡,表明在治疗量时无毒副作用,即无“反”的迹象。对急性肝损伤小鼠腹腔注射单味甘遂、海藻及其分别与甘草1∶1、1∶2、2∶1配伍制剂的LD50,死亡率提高,毒性明显增强,表明不利于急性肝损伤病例,也说明肝病时,对各配伍组的药和单味药解毒作用下降。
综上所述,海藻伍甘草“反”与“不反”与给药途径、动物功能状态(病理、生理)密切相关。
报道3[7]
根据“十八反”,将中药分为3组:甘草与甘遂、芫花、大戟、海藻。各组分别以单味中药5g,以及二味中药各5g配伍,放入三角烧瓶内,然后加入蒸馏水40ml,氯化钠1.2g,加塞,置于高压灭菌锅内,121℃,保持30min。取出药液,经4500r/min离心沉淀后,吸服上清液备用。
细菌活化:取干菌1支,加入4℃缓冲液(NaCl30g,NaHPO45g,KH2PO41g,蒸馏水1000ml,pH6.5)2ml,用旋涡混和器振荡均匀,20℃下平衡10min即为活化菌悬液,每毫升含活菌约107左右,菌液均为实验前新鲜配制。
发光强度测定:以0.8ml缓冲液、0.1ml中药制备液同放入测光杯内,对照组只放0.9ml缓冲液。由于中药色素对透光影响,故加入适量红糖溶液,以721型分光光度计测定所有标本的透光度相同。然后加入活化菌液0.1ml,置于20±1℃条件下作用5min后,用光电倍增管制成的测光仪测定发光强度的变化,以电压表示。
结果计数:测试结果用抑制发光率(以下简称抑光率)表示,可用下列公式计

甘草及其配伍药的抑光率:甘草81%、甘遂24%、芫花58%、大戟38%、海藻41%、甘草+甘遂70%、甘草+芫花79%、甘草+大戟60%、甘草+海藻81%。其中单味甘草和甘草+海藻的抑光率最高,均为81%。
报道4[8]
取体重20±2g小鼠,雌雄各半,按完全随机方法,每配伍药对分11组,9组为用药组,2组为对照组,每组10只,连续经口灌胃给药7d,观察动物死亡情况,测量给药前后其体重的变化。采用正交设计方法。编制因素位级组表。海藻、大戟、甘遂、甘草均按1990年版《药典》规定剂量,芫花按《全国中草药汇编》剂量,各药分大、中、小3个剂量级,按不同种类动物间体表比值换算剂量公式,分别换算成小鼠的灌胃剂量,各配伍药对为二个因素,列二因素三位级表,见表16-1-16。
表16-1-16 因素位级表

再采用数理统计学之二因素三水平将各药对配伍之药进行不同剂量组合,给药后动物死亡及体重变化见表16-1-17。
表16-1-17 体重变化情况

注:×死亡;与甘草组(E)比较:〇体重减轻;△体重增加比E快;□体重增加比E缓慢
毒性分析:各药对各剂量组对动物体重产生毒性反应无明显性别差异。各组配伍体重变化所在剂量组见表16-1-18。
表16-1-18 体重变化剂量组情况

本实验进一步说明药物与毒物之间的区别主要是剂量问题,同样是相同的两种中药配伍,由于配比剂量的不同,可能会产生不同的结果。在某配伍剂量时不会产生明显的毒性反应,体重增长正常,而在另一配伍剂量时却能产生严重的毒副作用,体重明显降低,甚至死亡。
报道5[9]
取市售甘草、海藻和芫花适量,分别将甘草与海藻(1∶2)、甘草与芫花(1∶2)和单独的甘草置于玻璃煮沸器内,用冷蒸馏水浸泡12h,然后煮沸40min,趁热过滤。滤液水浴浓缩,干燥备用。取小鼠24只,体重10~18g,雌雄兼用,随机分为4组,每组6只。1组:按每公斤体重给相当于原生药甘草1g和海藻2g的水溶液,灌胃,每天1次;2组:甘草和芫花,给药剂量和方法同1;3组:仅给甘草,剂量方法与1、2组相同;4组:生理盐水对照,灌与上述给药组相同体积的生理盐水。以上4组小鼠灌胃给药,观察11d,第10d,各组小鼠灌胃,禁食禁水12h,再放入4℃的冰箱内6h(连饲养笼一起放入,笼内有稻草),然后取出小鼠,观察活动状态。第11d灌胃6h后称重,断头取血进行RBC、WBC和SALT检测。解剖取出肝肾脾和胸腺称重并进行肝肾组织切片镜检。
活动状态和体重:各组小鼠在给药期间活泼如常,无耸毛、伏卧和少食等表现。体重增长,甘草芫花组较慢,其余各组无显着性差异。结果见表16-1-19。
16-1-19 给药期间各组小鼠体重增长情况(g,x±s)

*与生理对照组相比进行统计
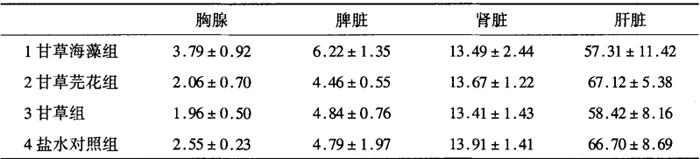
脏器系数:见表16-1-20。各组小鼠脏器系数统计处理结果:胸腺以1组为大,分别与3组和4组比较,差异非常显着(P<0.01),以3组为小,与4组比较有显着性差异(P<0.05);脾系数亦以1组大,3组小,1组和3组比较有显着性差异(P<0.05),但1组与4组比较,P<0.05,没有显着性差异。肾和肝系数各组之间均无显着性差异(P<0.05)。
表16-1-20 给药后各小鼠脏器系数(脏器mg/体重g)比较( )
)
对血细胞计数的影响:见表16-1-21。
表16-1-21 各组小鼠血细胞计数结果( )
)

*酸性和碱性细胞未列入统计
表16-1-21统计结果:红细胞计数甘草组偏低,与生理盐水对照组比较P<0.05,有显着性差异;白细胞总数2组较高,与生理盐水对照组比较P<0.05,有显着性差异。1组均数增高,但与生理盐水对照组比较P<0.05,无显着性差异。
耐饥饿和抗寒能力:各组小鼠经禁食12h,置低温处6h后,1组小鼠仍活泼如常,3组小鼠尚能进行缓慢的爬行活动,2组和4组均卷缩伏卧,无爬行能力,亦不能张口招头,呈木僵状态,经放入40℃的恒温箱内40min后,才恢复正常活动。
转氨酶检测和肝肾组织镜检观察:转氨酶以甘草芫花组较高,与生理盐水对照组比较P<0.05,有显着性差异。其他各组之间无显着差异。肝、肾组织切片镜检结果可是4个组均无特殊的病理改变。
本实验采用甘草与海藻伍用,不但未见到任何的毒性反应,相反却发现该组实验动物免疫功能明显增强。表现为胸腺明显大于单味甘草组和生理盐水对照组,另外中性白细胞比率比生理盐水对照组明显增高,动物饥饿和抗寒能力明显增强。根据这一结果推论,中药书中关于甘草反海藻是缺乏普遍意义的,很可能是特殊条件下的表现。
与生理盐水对照组比较,甘草芫花组小鼠体重增长较慢但与单味甘草组比又无显着性差异。该组小鼠血清转氨酶较高,但肝组织切片镜检未发出特殊病理改变。由于本实验未设单味芫花组,因此上述两项毒性影响尚难以断定是甘草芫花配伍所致。尤其是后一项毒性表现,有可能是芫花单独作用的结果(因甘草组动物血清转氨酶检测结果比生理盐水对照组低)。尽管如此,但我们临床工作者伍用甘草和芫花仍应慎重。
报道6[10]
称取海藻及甘草后,加水10倍量,浸30min,电炉加热至沸,30min后过滤,滤渣再加10倍量水,加热至沸,30min后过滤,合并两次滤液,浓缩至每毫升相当总生药量1g,冰箱保存备用。心电图均在不麻醉条件下观测,用XDH-3型心电图仪描记。体温测量用ST-1型数字体温计测量。LD50用改良Karber法,每批5组,每组8只小鼠,一般雄雌各半,观察72h。显着测验:t≥1.960,P≤0.05;t≥2.5758,P≤0.01;t≥3.2905,P≤0.001。
心电图及一般观察:在实验室条件下,小鼠正常心率为500~600次/min。小鼠腹腔注射甘草制剂,相当0.2g/10g体重,24h内死亡2/5.生存小鼠分别于24、48、72h观察心电图:2/3直至72h,心率无明显变化,但见心律不齐;1/3心率减慢,给药后24h280次/min;72h125次/min,偶见期外收缩;3/3可见频发短阵心房纤颤。72h后未再死亡。按0.1g/10g体重腹腔注射海藻制剂,24h内死亡1/5,48h又死2/5,心电图显示:给药后24h,心率全部减缓,132~192次/min,呈现束枝传导阻滞,频发短阵心房纤颤及2∶1期外收缩;48h后,1/2出现持续心房纤颤;72h全部死亡。合并海藻、甘草制剂,均按上述半量给药,腹腔注射后24h内死亡1/5、48h后又死2/5,心电图显示:给药后24h心率127~153次/min,全部出现束枝传导阻滞,频发短阵心房纤颤及期外收缩,1只明显心率迟缓、心律不齐,多发停搏;48h后心率102、104次/min;72h全部死亡。三个给药组给药后均呈衰竭、无反应状态,以甘草组最轻,二药合用组最重,且见全身抖动,两目无光、色淡;24h后体温普通下降,前、后自身对比,直肠温度下降,甘草组3.73℃(P<0.05),海藻组5.53℃(P<0.05),二药合用组12.9℃(P<0.001)。
半数致死量测定:海藻、甘草分别煎取,并按不同比例混合,小鼠腹腔注射半数致死量如表16-1-22,差异显着性测验如表16-1-23。
表16-1-22 海藻、甘草不同比例配合小鼠LD50(腹腔注射、72h)(LD50±SLD50)

表16-1-23 LD50值组间差异显着性测验(t测验、α值)

制剂方法的影响:为了配伍方便,避免多次称量、操作的误差干扰,我们尽量采取煎液分别按不同比例调配的方法,同传统煎煮方法有所不同。为探讨分煎后兑与合煎制剂的毒性有无区别,特对比等量海藻、甘草分煎后兑与合煎两种制剂的LD50:小鼠腹腔注给药,观察72h,合煎LD50=0.0678±0.01296g/10g,与分煎LD50=0.0762±0.0081g/10g对比,差异均不显着。
海藻的毒性显着大于甘草的毒性(P<0.01),因此,两药配伍,如果毒性是简单相加,其任何配伍比例的毒性均应小于单味海藻的毒性,海藻所占比例愈多,毒性愈接近单味海藻的毒性,且毒性应随海藻的减少而递减。本实验的结果,即使按总生药量计算,除0.25∶1和0.125∶1两组外,各组的毒性都不小于单味海藻的毒性,0.5∶1组的毒性且显着大于单味海藻的毒性,从2∶1至0.125∶1各组的毒性都不能由所含海藻的毒性解释,超过两药相加的毒性;0.25∶1、0.125∶1两组所含海藻量都甚少,但可使配伍后的毒性较单味甘草增加近1倍或1/2的毒性,也不是少量海藻毒性相加所都解释的。从毒性变化趋势来讲,毒性并没有随海藻递减而递减,而是在2∶1、1∶1和0.5∶1三组范围有一个毒性最大区域,此区上、下,毒性均有减少趋势。至少,海藻与甘草以2∶1至0.125∶1的范围内,两药的毒性有明显的协同作用。临床主要用于解毒的甘草对海藻的毒性不解,反有协同作用;甘草中加少量海藻,反而使甘草毒性增强;这类“反常”的现象,也许是称为“反”的主要根据。
虽然据本实验结果可见海藻、甘草以一定比例配伍时,毒性可以成倍增加,但是,按总药量计算,毒性最大的0.5∶1组LD50也只是5.55/kg;按体表面积估算,体重70kg的成人LD50约为43g,同法估算,窦昌贵实验值,1∶1配伍,成人LD50约为57g;金恩波等实验值,1∶1配伍,成人LD50约为12g,1∶2配伍9g,1∶4配伍7g:应该承认:这些配伍的毒性并不是十分剧烈。
报道7[11]
将家兔分成海藻组(雄性100,雌性200)、海藻甘草组(雄性12只,雌性23只),另设正常家兔对照组(雄性20只,雌性21只)。将海藻、海藻及甘草分别加3~5倍量水浸泡24h后煎煮0.5h,过滤,浓缩成1∶1液。按公斤体重单独或混合用药,一次送服。其中海藻组9g/kg,海藻甘草组(1∶1,各9g)18g/kg,正常对照组灌水10ml/kg。服药后5,24,48h进行观察,结果见表16-1-24。
表16-1-24 海藻、甘草服药后不同时间家兔的一般情况

家兔服药后5h,心脏采血,检查血象及血液生化值,结果见表16-1-25。
表16-1-25 海藻甘草配用对家兔血象及血液生化的影响

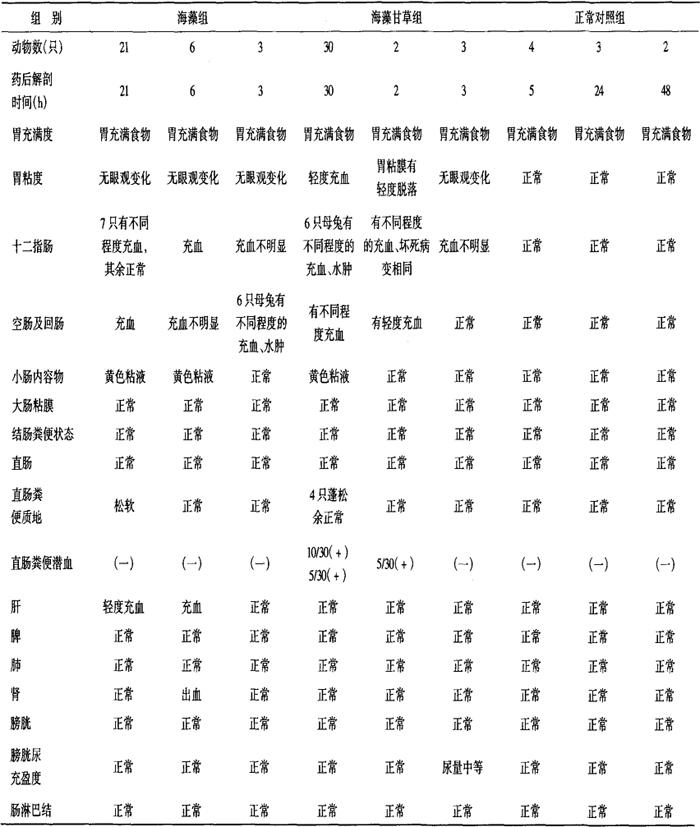
家兔服药后于5、24h处死,对其外部肠腺及脏器进行检查,再作切片,检查结果为:单味海藻组服药后5h,除小肠系膜有充血外,均未见明显变化,但在24h和48h,胃、小肠、圆小囊、肠系膜淋巴结、脾、肾等组织器官均有轻度充血、水肿,严重时尚有出血。另外,2例见到肝浊肿,1例脾网状细胞增生,1例肠系膜淋巴结出现明显的反应中心。
海藻甘草组:被检器官几乎均有充血现象,有的尚有水肿和出血。个别肝、肾轻度颗粒变性。肾、脾充血、出血很明显。脾网状细胞也有增生。小肠内容物除混有粘液外,尚夹杂红细胞。圆小囊和肠系膜淋巴结,散在吞噬黄棕色异物的巨噬细胞(表16-1-26)。
16-1-26 海藻甘草对家兔主要脏器的影响
报道8[12]
甘草:为豆科多年生草本植物甘草的根。单煎,称取定量药材加适量蒸馏水水洗2次后,用6倍量的蒸馏水浸泡0.5h,加热煮沸1h,4层纱布过滤,合并两次滤液,离心去渣,调配至所需浓度。海藻:为马尾藻科植物海藻子的全草,海藻的炮制煎法同甘草。
报道9[14]
取小鼠200只,随机分成20组,每组10只,以甘草、海藻、甘草加海藻3种药物煎剂,每种药物分为5个剂量组,腹腔注射,一次给药。对照组给予同等容量蒸馏水,给药方法相同。观察79h,用改良寇式法求得LD50值,结果:甘草煎剂组为252±0.033g/kg,海藻煎剂组为216±0.0247g/kg,甘草加海藻煎剂(1∶1)为243±0.0192g/kg。由上可见,甘草与海藻混合煎剂LD50值比海藻剂增大,表明甘草与海藻并无增毒作用,与甘草单煎剂组相比急性联合毒性测定方法二者是相加作用。经统计学处理P<0.05。
2.亚急性毒性试验[13]
取家兔59只,随机分为10组,中药9组,每组6只,对照组5只,于每日上午空腹时,定时灌胃给药,连续给药15d。其中大剂量用药:甘草海藻两组每只用38.63g/kg,甘草加海藻每只用42.6g/kg;中剂量用药:甘草与海藻两组每只用5.62g/kg,甘草加海藻8.23g/kg;小剂量用药:甘草与海藻两组每只用1.22g/kg,甘草加海藻每只用1.38g/kg;对照组每只用蒸馏水10ml。
在给药中,各组动物体重增加不明显,各组给药前后及组间的红细胞、白细胞计数,经统计学处理无显着差异,仅大剂量甘草加海藻组,血糖含量稍升高,给药前为5.49mmol/L,用药15d后为7.06mmol/L,停药15d后为6.5mmol/L。这一结果表明这种用药方法可能使血糖升高,但升高的比例不大,与同剂量其他组相比,差异不显着,表明与配伍无关。在给药15d后,每组动物处死一半,余下一半在停药后15d处死,逐只进行解剖,肉眼观察心、肝、肾等,称脏器重量,进行脏器系数比较,组织切片,H·E染色镜检。对肝细胞内糖原含量和肾脏碱性磷酸酶活性检查,表明各组间组织形态、病理变化均未显示差异。
3.其他毒性试验报道
江西医学院生物学教研组报道:家兔灌胃给药,海藻与甘草以3∶5、4∶6、5∶7比例配合递增,共3d,未致死亡,血白细胞分类显示假性嗜伊红白细胞增多,淋巴细胞减少。李安域等报告:家兔灌胃给药,用海藻∶甘草为2∶1的煎液,未见中毒反应。
陈氏报道,大鼠灌胃给药,海藻、甘草等量煎液,每日2次,连续7d,经多项生理、生化指标及解剖、组织学检查,均未见异常。
黄氏报道:灌胃给药,猪3只(海藻、甘草等量)、牛、马各2只(海藻∶甘草=2∶1),均未见毒性反应。有报道以海藻、甘草等量散剂温水冲灌给药,牛、猪各2只;海藻∶甘草=2∶1的散剂冲灌给药,兔4只,仅常量给药的牛1只有轻微反应,其余无论常量、大量均未见毒性反应。
窦氏首先报道:小鼠腹腔给药,用50%乙醇的100%浸液,每毫升含海藻、甘草各9.5g,测定LD50,统计判定:海藻、甘草有相互增强毒性的作用,LD50=7.3±1.0,而甘草ID50=12.4±0.9,海藻LD50=23.6±8.9。金氏报告,煎液减压浓缩,50℃以下干燥成粉,用时与羧甲基纤维素混合制成混悬液,给小鼠腹腔注射,甘草LD507.99±0.55g/kg,海藻LD50=1.59±0.049g/kg,海藻∶甘草为1∶1的LD50=1.52±0.03g/kg,1∶2的LD50=1.15±0.25g/kg,1∶4的LD50=0.88±0.03g/kg;甘草LD50=7.99±0.55g/kg,海藻LD50=1.59±0.04g/kg;随伍用甘草量的增加,毒性也增加,皮下注射1/2LD50、1/4LD50甘草制剂,同时腹腔注射海藻制剂,测得海藻ID50分别为0.704±0.045g/kg、1.082±0.045,并且仍可见到甘草用量增加,海藻毒性增强的情况。认为海藻配甘草毒性增强不是由于混煎引起的理化改变,可能是药物进入动物机体后产生相互作用的结果,杨氏报告:小鼠经口给药,等量海藻、甘草水浸煎或水煎,每只给药0.6g,均不见毒性反应,腹腔注射,海藻每只0.1~0.3g,甘草每只0.5~1.0g仍不见毒性反应,但两药各0.3g煎液,8只全部死亡,剖检:小肠水肿发红。
【临床应用】
1.治疗乳腺增生
朱氏[14]自拟海藻甘草汤治疗乳腺小叶增生患者60例,获效甚佳。60例患者中,女性56例,男性4例;年龄最小22岁,最大45岁;病程最短者3个月,最长者14年。属单侧乳腺发病者39例,双侧发病者13例;手术后复发的8例。基本方组成:海藻、银花、连翘、赤芍各15g,当归尾、皂角刺、炮山甲、青皮、陈皮、甘草各10g,郁金6g。加减:质坚加川贝母、重楼各10g;触痛明显加野菊花10g,蒲公英、紫花地丁各30g;痛甚加乳香、没药各6g。服法:首剂药液可取杯饮,每次15~30ml,观察有无过敏反应,若药后无不适,可按常规服用,每日1剂,连服5剂为1疗程。结果:32例痊愈(服药1~2疗程后,肿块消失,临床诸症悉除),24例有效(服药2~3疗程后,肿块范围明显缩小,质地变软,自觉无疼痛不适之感),4例无效(连续服药3~4疗程,肿块无明显缩小,质坚,疼痛略减)。
刘氏[9]等报道:用海藻15g,甘草3g,治疗乳腺增生患者30例,用药4周为1疗程,2个疗程后统计疗效,结果近期治愈10例,显效11例,好转5例,无效4例,总有效率87%。
2.治疗湿痰咳喘,脾胃虚寒等症
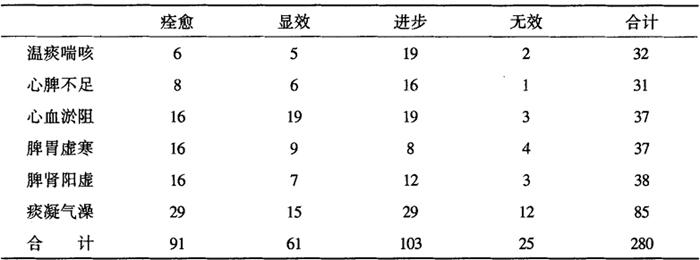
林氏[15]等用海藻甘草加味制成拮抗丸,治疗湿痰咳喘、脾胃虚寒等证,纳入病例共计280人,疗效标准为:凡患者全身症状消失,临床检查已愈,观察2月未复发为痊愈;自觉症状和辅助检查均有明显改善者为显效;或检查证实,症状略好转者为进步;或治1月以上,无明显变化者为无效。280例中治愈91人(32.5%),显效61(21.78%)进步103人(36.78%),有效率为91.64%,无效25人(8.9%),占总数8.9%。
表16-1-27 各型疗效情况
3.其他
林氏[16]治疗其他疑难杂症250例,治愈78人,显效54人,进步96人,有效率为91.92%;无效22人。未发现不良反应。另本配伍可治疗视网膜静脉阻塞[17]。
古有记载将海藻配甘草组方内消瘰疬丸《疡医大全》治疗瘰疬;海藻玉壶丸,防风羌活汤《医宗金鉴》,治疗瘿瘤,现有用该配伍组方治疗,颈淋巴结核、甲状腺肿,甲状腺功能亢进、乳房囊性增生、子宫肌瘤、结核性胸膜炎、骨结核、骨瘤、肠系膜淋巴结核、支气管哮喘、高血压动脉硬化、脑血管意外、再生障碍性贫血、秃头症等[18]。
【不良反应】
为了验证海藻与甘草是否相反,中医不乏自己试服者:蒲志孝介绍蒲辅周先生早年曾自服海藻、甘草合剂,服后“稍感心中难受”;刘建德自服生甘草10g,海藻15g煎液,服后无不良反应;其余各家也无不良反应报道[18]。
【参考文献】:
1 许亚,孙晓进,王志刚,等.甘草、海藻及其相伍用对小鼠肝药酶的影响.辽宁中医杂志,1998;(25):84
2 刘源,陈馥馨,高晓山.中药十八反研究.北京:中医古籍出版社,1991:173
3 刘源,陈馥罄,高晓山.中药十八反研究.北京:中医古籍出版社,1991:175
4 刘源,陈馥罄,高晓山.中药十八反研究.北京:中医古籍出版社,1991:177
5 刘源,陈馥罄,高晓山.中药十八反研究.北京:中医古籍出版社,1991:214
6 刘源,陈馥罄,高晓山.中药十八反研究.北京:中医古籍出版社,1991
7 杨安泰,张丽英,金彩琪,等.用发光细菌研究中药“十八反”.上海中医药杂志,1989;(6):2
8 关天增.藻戟遂芫俱戟草的实验研究.河南中医药学刊,1995;10(1):13
9 刘懋生,聂绍政,吴柄盛,等.海藻芫花反甘草实验研究.中药通报(增刊),1986;(1):194
10 高晓山,林娜,王旭华.海藻反甘草实验初报.中药通报(增刊),1986;(1):195
11 杨致礼,王佑之,吴成材,等.中药十八反在家兔上的毒性试验.中药通报(增刊),1986;(1):197
12 越玉文.中药海藻及甘草的配伍研究.北京中医药大学40周年校庆论文集,1998:367
13 刘源,陈馥罄,高晓山.中药十八反研究.北京:中医古籍出版社,1991:247
14 朱守庆,朱红梅.海藻甘草汤治疗乳腺小叶增生60例临床观察.浙江中医杂志,1996;31(8):346
15 林通国,李傲芫,赵呈明,等.中药“十八反”之研究.附拮抗丸的应用及初步实验报告.成都中医学院学报,1981;(2):46
16 林国通.中药十八反之研究-250例拮抗丸的应用分析.成都中医学院学报,1981;(3):58
17 刘莉.清营汤化裁治疗视网膜静脉阻塞.中西医结合眼科杂志,1997;15(4):206
18 苗明三.常用中药毒理学.北京:中国中医药出版社,1997:357