●帕力卡西托
出处:按学科分类—医药、卫生 第二军医大学出版社《新药临床应用手册二》第391页(2937字)
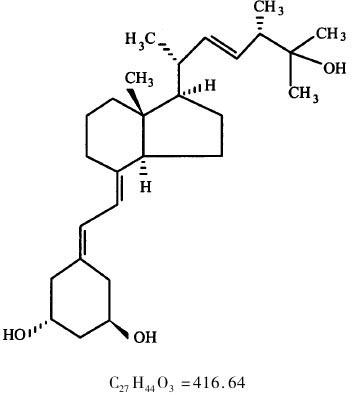
【化学名称】(7E,22E)-19-nor-9,10-secoer gosta-5,7,22-triene-1α,3β,25-triol
【化学结构】
【药理作用】本品是维生素D类似物,适用于治疗副甲状腺功能亢进,极适合于肾衰长期透析的病人。这类病人多达80
%发生继发性副甲状腺功能亢进。几项研究已经表明,静脉给予骨化三醇,维生素D的活性代谢物可能抑制副甲状腺激素水平;然而,由于这些药物经常在病人透析时与碳酸钙(作为磷酸结合剂)同用,会进一步加重高血钙。因此,常常被排除而不能使用。高磷酸血症是长期透析病人另一个常见的问题,也会被骨化三醇加重。因此,为治疗副甲状腺功能亢进,研制了本品。
在体外,本品对猪小肠维生素 D 受体结合的活性小于骨化三醇3.5倍。这种活性在缺乏维生素 D的大鼠体内也被观察到。在这种情况下,本品在刺激小肠的钙运送和运用钙形成骨方面的活性小于骨化醇10 ~ 100倍。在一大鼠慢性肾衰继发副甲状腺功能亢进的模型,每天经腹腔给予本品 75 ng,连用 8 d。抑制血清副甲状腺激素(PTH)近 73 %,导致恢复到正常水平,但是并不引起高钙血症或增加血清磷酸盐。本品较低剂量虽然效果小但也有效。相似的疗效在用骨化醇每天8 ng,也可观察到,但是伴有高钙血症和高磷酸盐血症。
在一项切除副甲状腺的大鼠研究中,喂以缺钙或缺磷的饲料,动物经腹腔给予本品0.1或 1 mg,或骨化醇 0.1 mg连续 9d。在这项研究中,本品的促进钙和磷从骨质的吸收活性大约为骨化醇的1/10,而在抑制 PTH 的效果则是相等的。
在一项临床前的肾切除引起尿毒症的大鼠模型,每周 3次经腹腔给予本品25或 100 ng;或给骨化醇 2或 6 ng;或安慰剂。评价了对副甲状腺的生长和对小肠维生素 D受体的含量。大鼠在整个研究过程中,被喂以含 1.0 % 钙 /0.8 %磷的饲料。高剂量的骨化醇明显的降低 PTH 水平,从(52.7±10.2)p g/ml到(25.7 ±6.7) ng/ml。然而在这个剂量下,骨化醇也引起血清离子化钙和磷的水平明显增高。相反,本品与高剂量骨化醇一样有效降低血清PTH 时,但不影响血清钙或磷的水平。本品在 100 ng剂量时,降低 PTH水平到(20.7 ±3.1)p g/ml,并抑制副甲状腺生长近 50%以上。用本品治疗的大鼠内源性骨化醇的水平,也明显减低。用更高剂量的骨化醇治疗组动物比本品治疗组显示维生素D受体增加,这个差别可能由于前述的本品治疗的大鼠内源性骨化醇减低,而与小肠维生素D 受体和血清骨化醇直接有关。这些结果证明本品的作用是在副甲状腺的水平而不是在小肠,故本品不会引起高钙或高磷血症。因此本品是一理想的治疗副甲状腺功能亢进的药物。本品在体内也已显示抑制免疫球蛋白和胸腺淋巴细胞的产生,表明它可能作为体内的免疫抑制剂。
【药物动力学】对16例血透病人进行了药动学研究。本品在结束血透后按剂量0.04,0.08,0.16或 0.24 ng/kg静注。整个治疗期间为 4周(共给本品 12次)。在整个试验的剂量范围,本品的消除是双相的,药动学呈线性。终末消除半衰期从13 ~ 30 h,但未见药物蓄积。本品最高给药剂量后,Cmax和 AUC0 ~44分别为(1 605 ±477)p g/ml和(20 000 ±2 136)p g/ml。Cmax=(1 061±117)p g/ml,线性药动学和双相消除除了 AUC0 ~ ∞比例的降低和t1/2较短外。一般与肾功能正常者类似。表明本品部分的经肾脏途径消除而有些可能经血透排除。因此本品宜用于血透病人。本品的排泄主要经肝胆排泄,大约剂量的74 % 在粪便中,16 % 在尿中。多剂量连续使用未发现药物蓄积。
【适应证】本品适用于预防和治疗继发性副甲状腺功能亢进伴有慢性肾衰的病人。在临床试验中,本品对透析的慢性肾衰病人在6周内可减少平均副甲状腺素浓度近 30 % 。
【剂量与用法】本品由静脉滴注给药。开始剂量由 0.4 μg/kg到 1μg/kg(即病人体重 70 kg为 28到 70μg/kg),当透析期间每天给药不超过 1次。剂量高达 2.4 μg/kg(168μg)已被安全的使用。治疗初期,应当经常测定血清钙和磷(每两周测1次)。如果开始剂量,疗效不满意,剂量可在 2 ~ 4 周,增加到 20 ~40 μg。如果血钙升高或 Ca×P 大于75,应当立即减低剂量或停药,直到这些数据正常后,本品治疗可由低剂量从新开始。PTH浓度也可用于确定本品的最佳剂量和监护治疗。测定 PTH被推荐为可靠的确定肾衰病人生物学活性 PTH 的方法。慢性肾衰病人的PTH浓度范围不大于非尿毒症的正常上限的 1.5 到 3 倍。如果 PTH浓度在此范围或降低 30 % 到 60 % ,则应当维持现在的剂量。如果 PTH 的浓度升高或降低小于 30 % ,本品剂量应当增加;然而,PTH浓度降低大于 60 % ,剂量应当减少。
【临床评价】在三项安慰剂对照研究中,本品治疗导致慢性肾衰病人在治疗开始6周内,PTH 降低 30 % 。在三项12周三期临床试验中,本品被给予透析病人,开始剂量以 0.04μg/kg,每周3次。剂量每周按 0.04 μg/kg增加,直到 PTH浓度由基线降低 30% ,或小于100p g/ml,或直至观察到钙、磷浓度的不良反应。
【不良反应】使用本品最常见的不良反应包括恶心(13% )、呕吐(8 %)和水肿(7 % )。在临床研究中有 7 %的病人因服用本品发生不良反应而停药,而在服用安慰剂的病人中有 2 %的病人因不良反应而停药。
【注意事项】本品被列为妊娠 C类药品。它的安全性在儿童还未确定。本品禁忌用于高钙血症或确证维生素D 中毒的病人。本品不应与磷酸盐或维生素 D类药物同时服用。病人应当充分认识限制饮食钙和磷的摄入量的重要性。为控制血清磷的浓度需要限制磷酸盐药物并应避免含大量铝的产品。因为高钙血症增加洋地黄的毒性,如果需要同时服用这两种药物需要密切监护。
【制剂规格】注射剂:1 ml、2 ml和 5 ml安瓿,每毫升含本品50μg。
【生产厂家】美国 AbbottLaboratories。