食品中钙的测定方法
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第190页(19133字)
一、葡萄糖酸钙
化学名:葡萄糖酸钙(Calcium gluconate)
结构式:

分子式:C12H22O14Ca·H2O
相对分子质量:448.39(一水物),430.38(无水物)
(一)葡萄糖酸钙的鉴别
1.试剂和溶液
1.1 冰乙酸(GB1628)。
1.2 苯肼:新蒸馏的试剂。
1.3 三氯化铁溶液:取三氯化铁9g,加水使溶解成100mL,即得。
2.操作步骤
2.1 取本品1g,加水40mL使之溶解,取此溶液按《中华人民共和国药典》1990年版,二部中附录39页检验应显钙盐的鉴别反应。
2.2 取本品0.5g,置试管中,加水5mL,微热溶解后,加冰乙酸0.7mL与新蒸馏的苯肼1mL,置水浴上加热30min后,放至室温,用玻璃棒摩擦试管的内壁,渐生成黄色的结晶。
2.3 取本品0.1g,加水5mL溶解后,加三氯化铁试液1滴,显深黄色。
(二)葡萄糖酸钙含量的测定
1.试剂和溶液
1.1 氢氧化钠(GB629):1mol/LNaOH溶液。
1.2 乙二胺四乙酸二钠(GB1401):0.05mol/L乙二胺四乙酸二钠标准滴定溶液。
1.3 钙紫红素指示剂:取钙紫红素0.1g,加无水硫酸钠10g,研磨均匀。
2.测定方法
取本品0.5g,精密称定(准确到0.0001g),加水100mL,微热使溶解,放至室温,加氢氧化钠溶液15mL与钙紫红素指示剂0.1g,用0.05mol/L乙二胺四乙酸二钠标准溶液滴定至溶液由紫色转变为纯蓝色。
3.分析结果的表述
葡萄糖酸钙含量(w)以质量分数计,按式(9-9)计算:

式中 V——乙二胺四乙酸二钠标准滴定溶液的体积,mL
c——乙二胺四乙酸二钠标准滴定溶液的实际浓度,mol/L
m——样品的质量,g
0.4484——与1.00mL乙二胺四乙酸二钠标准滴定溶液〔c(EDTA)=1.000mol/L〕相当的以克表示的葡萄糖酸钙的质量
所得结果取两次平行测定的算术平均值,保留小数点后的2位数字。
4.允许差
两次平行测定的结果相对偏差不大于0.3%。
二、磷酸氢钙
化学名:磷酸氢钙(Calcium monohydrogen phosphate)
结构式

分子式:CaHPO4·2H2O
相对分子质量:172.10(二水物)
(一)磷酸氢钙的鉴别
1.试剂和溶液
1.1 硝酸银(GB670):50g/L溶液。
1.2 冰乙酸(GB676)。
1.3 草酸铵(HG3-976):30g/L溶液。
2.操作步骤
2.1 试样用硝酸银溶液湿润后即呈黄色。
2.2 0.1g试样,加5mL冰乙酸,煮沸冷却后过滤,滤液加5mL草酸铵溶液,产生白色沉淀。
(二)磷酸氢钙的含量测定
方法提要:在试验溶液中,加入过量的乙二胺四乙酸二钠溶液,与钙络合,以酸性铬蓝K-萘酚绿B为指示剂,用锌标准溶液滴定过量的乙二胺四乙酸二钠。
1.试剂和溶液
1.1 盐酸 (1+4)溶液。
1.2 氨-氯化铵缓冲溶液,pH10。
1.3 酸性铬兰K-萘酚绿B混合指示液(KB指示液) 称取0.3g酸性铬蓝K和0.1g萘酚绿B,溶解于水中,稀释至100mL。
1.4 铬黑T 5g/L指示液。
1.5 乙二胺四乙酸二钠(EDTA) 约0.05mol/L乙二胺四乙酸二钠标准滴定溶液。
1.6 硫酸锌 c(ZnSO4)约0.05mol/L(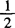 ZnSO4)标准滴定溶液。称取14g硫酸锌,溶于1000mL水,摇匀。
ZnSO4)标准滴定溶液。称取14g硫酸锌,溶于1000mL水,摇匀。
标定:量取35mL配制好的硫酸锌溶液,加70mL水及10mL氨-氯化铵缓冲溶液,加5滴铬黑T指示液,用EDTA标准滴定溶液滴定至溶液由紫红变为纯蓝色。同时作比对试验。
硫酸锌标准滴定溶液的浓度c( ZnSO4)按式(9-10)计算:
ZnSO4)按式(9-10)计算:

式中 V1——滴定消耗EDTA标准滴定溶液的体积,mL
V2——比对试验消耗EDTA标准滴定溶液的体积,mL
c1——EDTA标准滴定溶液的浓度,mol/L
V——硫酸锌溶液的体积,mL
2.操作步骤
称取0.4g试样,精确至0.0002g,置于100mL烧杯中,加12mL盐酸溶解,移入250mL容量瓶中,加水至刻度,摇匀。用移液管移取25mL试验溶液置于300mL锥形瓶中,加25.00mLEDTA标准滴定溶液,加50mL水、10mL氨-氯化铵缓冲溶液,放置5min,加4滴KB指示液,用硫酸锌标准滴定溶液滴定至溶液由蓝变为紫色,30s紫色不褪即为终点。
同时作比对试验。
3.分析结果的表述
磷酸氢钙(CaHPO4·2H2O)质量分数(w)按式(9-11)计算:

式中 V0——比对试验所消耗的硫酸锌标准滴定溶液的体积,mL
V——试验溶液所消耗的硫酸锌标准滴定溶液的体积,mL
c—— ZnSO4标准滴定溶液的实际浓度,mol/L
ZnSO4标准滴定溶液的实际浓度,mol/L
m——试样的质量,g
0.1721——每毫摩CaHPO4的质量,g/mmol
所得结果应表示至1位小数。
4.允许差
两次平行测定结果之差不大于0.3%,取其算术平均值为测定结果。
三、磷酸二氢钙
化学名:磷酸二氢钙(Calcium Phosphate Monobasic)
分子式:Ca(H2PO4)2·H2O
相对分子质量:252.07
(-)磷酸二氢钙的鉴别
1.试剂和溶液
1.1 硝酸银:10g/L溶液。
1.2 草酸铵:3g/L溶液。
1.3 盐酸:(1+1)溶液。
1.4 硝酸:(1+14)溶液。
2.操作步骤
2.1 钙离子 称量约0.1g试样,溶于2mL盐酸(1.1.3)及20mL水中,溶解后加5mL草酸铵溶液(1.1.2)有白色沉淀生成。
2.2 磷酸根离子 称取少量试样,用硝酸溶液(1.1.4)溶解后,滴加硝酸银溶液(1.1.1),有黄色沉淀生成。
(二)磷酸二氢钙含量测定
1.原理
在试样溶液中,加入过量的乙二胺四乙酸二钠溶液,与Ca2+络合,以酸性铬蓝K-萘酚绿B为指示剂,用锌标准溶液滴定过量的乙二胺四乙酸二钠。
2.试剂和溶液
2.1 乙二胺四乙酸二钠 0.05mol/LEDTA标准溶液。
2.2 硫酸锌约0.05mol/L(1/2ZnSO4)标准溶液。
2.3 氨水。
2.4 氯化铵。
2.5 氨-氯化铵缓冲溶液:pH10。
2.6 酸性络蓝K-萘酚绿B混合指示剂(KB混合指示剂)。
配制:称取0.3g酸性络蓝K和0.1g的萘酚绿B,溶解于水中,稀释至100mL。
2.7 盐酸 (1+1)溶液。
3.空白试验
用移液管移取25mLEDTA标准溶液(2.1)置于500mL锥形瓶中,加50mL水,10mL氨-氯化铵缓冲溶液(2.5),放置5min,加4滴KB混合指示剂(2.6),用硫酸锌标准溶液(2.2)滴定至溶液由蓝变为紫色,30s内紫色不褪即为终点。
硫酸锌标准溶液的浓度c2按式(9-12)计算:

式中 V1——EDTA标准溶液的体积,mL
c1——EDTA标准溶液的浓度,mol/L
V2——滴定中消耗的硫酸锌标准溶液的体积,mL
4.测定方法
称量约0.8g试样,精确到0.0002g,置于100mL烧杯中,加少量水润湿,加8mL盐酸溶液(2.7)溶解,移入250mL容量瓶中,加水至刻度,摇匀。用移液管移取25mL试液置于500mL锥形瓶中,再移取25mLEDTA标准溶液(2.1),加50mL水,加10mL氨-氯化铵缓冲溶液(2.5),放置5min,加4滴KB混合指示剂(2.6),用硫酸锌标准溶液(2.2)滴定至溶液由蓝变为紫色,30s内紫色不褪即为终点。
5.分析结果的表述
以质量分数表示的磷酸二氢钙含量(以Ca计)(w)按式(9-13)计算:

式中 V1——加入的EDTA标准溶液的体积,mL
c1——EDTA标准溶液的浓度,mol/L
V2——滴定中消耗硫酸锌标准溶液的体积,mL
c2——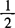 ZnSO4标准溶液的浓度,mol/L
ZnSO4标准溶液的浓度,mol/L
m——试样的质量,g
0.04008——每毫摩Ca2+质量,g/mmol
两次平行测定结果之差不大于0.2%,取其算术平均值为测定结果。
四、乙酸钙
化学名:乙酸钙(Calcium Acetate)
结构式
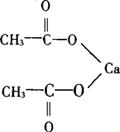
分子式:C4H6O4Ca
相对分子质量:158.17(无水物),176.18(一水物)
(一)乙酸钙的鉴别
1.试剂和溶液
1.1 盐酸(GB622)。
1.2 硫酸(GB625)。
1.3 三氯化铁(HG3-1085)。
1.4 草酸铵(HG3-976) 4%溶液。
1.5 样品溶液的制备 称取样品0.1g,加20mL水溶解,即得。
2.操作步骤
2.1 取样品溶液(1.1.5)2mL,加草酸铵试液1滴,即生成白色沉淀。
2.2 取铂丝,用盐酸润湿,先在无色火焰上烧至无色,然后蘸取样品溶液(1.1.5),在无色火焰上燃烧,火焰呈砖红色。
2.3 取样品0.2g,加硫酸0.5mL,加热,即发生乙酸的特臭。
2.4 取样品溶液(1.1.5)2mL,滴加三氯化铁试液1滴,溶液呈深红色,加稀盐酸,红色即褪去。
(二)乙酸钙含量测定
1.原理
样品中加入三乙醇胺溶液将Fe3+、Al3+、Mn2+等离子掩蔽起来,加入氢氧化钠试液,使溶液pH大于12,Mg2+则形成Mg(OH)2沉淀,排除干扰后,在此碱性溶液中,加入钙紫红素指示剂,用乙二胺四乙酸二钠标准滴定液滴定钙离子。
反应式如下:Ca2++H2Y2-→CaY2-+2H+试
2.试剂和溶液
2.1 氢氧化钠(GB629)。
2.2 三乙醇胺(化学纯) 20%溶液。
2.3 乙二胺四乙酸二钠(GB1401) 0.05mol/L标准滴定溶液。
2.4 钙紫红素。
3.测定方法
称取样品约0.2g,准确至0.0002g,加水100mL溶解后,加入三乙醇胺试液5mL,氢氧化钠试液15mL,钙紫红素指示剂约0.1g,然后用0.05mol/L乙二胺四乙酸二钠标准滴定溶液滴定至溶液由红色变为纯蓝色即得。
4.分析结果的表述
乙酸钙含量以质量百分数(w1)表示,按式(9-14)计算:

式中 w——乙酸钙含量的质量分数,%
V——乙二胺四乙酸二钠标准滴定溶液体积,mL
c——乙二胺四乙酸二钠滴定溶液的实际浓度,mol/L
m——样品的质量,g
w1——水分的质量分数,%
0.1582-每毫摩C4H6O4Ca质量,g/mmol
所得结果取两次平行测定的算术平均值,保留4位有效数字。
注:水分测定:称取样品约0.2g,准确至0.0002g,按《中华人民共和国药典》1990年版二部附录55页费休氏法测定。
5.允许差
两次平行测定结果的相对偏差不超过0.3%。
五、活性钙
化学名:活性钙(Active Calcium)
别名:活性钙离子
化学结构:本品所含钙的主要成分为氢氧化钙(约98%),另含微量氧化镁(MgO)、氧化钾(K2O)、三氧化二铁(Fe2O3)、五氧化二磷(P2O5)、氧化钠(Na2O)和锰离子。
六、丙酸钙
化学名:丙酸钙(Calcium propionate)
结构式

分子式:(CH3CH2COO)2Ca·(0~1)H2O
相对分子质量:186.22(无水盐)
(一)丙酸钙的鉴别
1.试剂和溶液
1.1 硫酸 (5.7+100,体积分数)溶液。
1.2 草酸铵 4%溶液。
1.3 盐酸。
1.4 冰乙酸。
2.操作步骤
2.1 丙酸 称取0.5g样品,溶于50mL水,加5mL硫酸(1.1),加热,应有特殊臭味产生。
2.2 钙 称取0.5g样品,溶于50mL水,加草酸铵溶液(1.2),即发生白色沉淀,能溶于盐酸(1.3),不溶于乙酸(1.4)。
(二)丙酸钙含量测定
1.试剂和溶液
1.1 乙二胺四乙酸二钠 0.05mol/L标准溶液,按GB-601规定配制。
1.2 氢氧化钠 10%溶液。
1.3 钙试剂羧酸钠。
1.4 硫酸钾。
1.5 钙试剂羧酸钠指示剂 称取0.5g钙试剂羧酸钠,加50g硫酸钾混匀。
2.测定方法
样品在120℃干燥失重后,称取1g样品,准确至0.0002g,溶于水,移入100mL容量瓶中,稀释至刻度。量取25.00mL,加75mL水,用0.05mol/L乙二胺四乙酸二钠标准溶液(1.1.1)滴定至近终点,加15mL氢氧化钠溶液(1.1.2),放置1min。加0.1g钙试剂羧酸钠指示剂(1.1.5),以0.05mol/L乙二胺四乙酸二钠标准溶液(1.1.1)继续滴定至溶液红色消失呈现蓝色。
3.分析结果的表述
丙酸钙质量含量(w)按式(9-15)计算。

式中 V——乙二胺四乙酸二钠标准溶液用量,mL
c——乙二胺四乙酸二钠标准溶液的浓度,mol/L
m——样品质量,g
0.1862——每毫摩(CH3CH2COO)2Ca的质量,g/mmol
两次测定结果之差不得大于0.2%,取其算术平均值。
七、柠檬酸钙
化学名:柠檬酸钙(Calcium Citrate)
结构式:

分子式:C12H10O14Ca3·4H2O
相对分子质量:570.50
柠檬酸钙鉴别
1.试剂和溶液
1.1 柠檬酸钙。
1.2 硝酸。
2.操作步骤
2.1 取本品在300~400℃灼烧1h,所得残渣呈钙盐反应(见磷酸三钙)。
2.2 取0.5g本品溶于10mL水和2.5mL稀硝酸(1+9)中,溶液呈柠檬酸盐反应(见柠檬酸钠)。
八、乳酸钙
化学名:乳酸钙(Calcium lactate)
结构式

分子式:C6H10O6Ca·XH2O
相对分子质量:218:22(无水物)
(一)乳酸钙的鉴别
1.试剂和溶液
1.1 高锰酸钾(GB643) 0.1mol/L( KMnO4)溶液。
KMnO4)溶液。
1.2 草酸铵(HG3-976) 4%溶液。
1.3 硫酸(GB625)。
2.操作步骤
于一份样品溶液中,滴加硫酸使呈酸性,加适量0.1mol/L( KMnO4),加热,即发生乙醛的特殊臭味。于另一份样品溶液中,滴加4%草酸铵溶液,即发生白色沉淀,能溶于盐酸,不溶于乙酸。
KMnO4),加热,即发生乙醛的特殊臭味。于另一份样品溶液中,滴加4%草酸铵溶液,即发生白色沉淀,能溶于盐酸,不溶于乙酸。
(二)乳酸钙含量测定
1.试剂和溶液
1.1 乙二胺四乙酸二钠 0.05mol/L标准溶液,按GB601配制和标定。
1.2 氢氧化钠 10%溶液。
1.3 钙混合指示剂 0.1g钙试剂羧酸钠盐和20g于110℃干燥过的氯化钠(GB1266)混合研磨。
2.测定方法
称取干燥失重后样品0.3g,精确至0.0002g,先滴加25mL0.05mol/L乙二胺四乙酸二钠标准溶液,加5mL10%氢氧化钠溶液,0.1g钙混合指示剂,继续用0.05mol/L乙二胺四乙酸二钠标准溶液滴定至蓝色。
3.分析结果的表述
乳酸钙的质量分数(w)按式(9-16)计算。

式中 V——乙二胺四乙酸二钠标准溶液用量,mL
c——乙二胺四乙酸二钠标准溶液浓度,mol/L
m——样品质量,g
0.2182——每毫摩C6H1oCaO6的质量,g/mmol
九、碳酸钙
化学名:碳酸钙(Calcium carbonate)
分子式:CaCO3
相对分子质量:100.09
(一)碳酸钙的鉴别
1.试剂和溶液
1.1 氢氧化钙 0.3%溶液,取上层澄清液。
1.2 草酸铵 3.5%溶液。
1.3 酚酞指示剂 1%乙醇溶液。
1.4 盐酸 (1+2)溶液。
1.5 冰乙酸。
1.6 氨水 (1+3)溶液。
2.操作步骤
2.1 碳酸盐的鉴定 取试样少许,加盐酸溶液(1.4)后即产生二氧化碳气,通入氢氧化钙溶液(1.1.1)中,即产生白色沉淀。
2.2 钙的鉴定 取上述试液,加酚酞指示液(1.3),用氨水(1.6)调至中性,加入草酸铵溶液(1.2)即产生白色沉淀,此沉淀能在盐酸溶液(1.4)中溶解,而在冰乙酸(1.5)中不溶解。
取铂丝,用盐酸润湿后在无色火焰中燃烧至无色,蘸取试样再烧,火焰即显砖红色。
(二)碳酸钙含量测定
1.原理
在pH大于12的介质中,用三乙醇胺掩蔽少量的铁(Fe3+)、铝(A13+)、锰(Mn2+)等离子,以钙试剂为指示剂,用乙二胺四乙酸二钠标准溶液滴定钙(Ca2+),过量的乙二胺四乙酸二钠夺取已与指示剂络合的钙(Ca2+),游离出指示剂,根据颜色的变化判断反应的终点。
2.试剂和溶液
2.1 盐酸 6mol/LHCl溶液。
2.2 氯化钠。
2.3 氢氧化钠 10%溶液。
2.4 三乙醇胺 30%水溶液。
2.5 氨水-氯化铵缓冲溶液(pH 10)。
10)。
2.6 氧化锌 容量基准。
2.7 铬黑T 0.5%溶液。
2.8 钙指示剂 称取10g预先在105~110℃下烘干2h的氯化钠,置于研钵内研细,加入0.1g钙试剂,研细,混匀。
2.9 乙二胺四乙酸二钠 0.02mol/L标准溶液。
3.操作步骤
称取0.6g预先在105~110℃下烘至恒重的试样(称准至0.0002g),置于烧杯中,用少量水湿润,盖上表面皿,滴加盐酸溶液(2.1)至全部溶解,加50mL水,全部移入250mL容量瓶中,加水至刻度,摇匀。准确移取25mL置于250mL锥形瓶中,加5mL三乙醇胺溶液(2.4)、25mL水、5mL氢氧化钠溶液(2.3)和少量钙指示剂(2.8),用乙二胺四乙酸二钠标准溶液(2.9)滴定至溶液由红色变为纯蓝色。
4.分析结果的表述
碳酸钙的质量分数(w)按式(9-17)计算:

式中 V——滴定所消耗乙二胺四乙酸二钠标准溶液的体积,mL
c——乙二胺四乙酸二钠标准溶液的浓度,mol/L
m——试样质量,g
0.05——每毫摩 CaCO3的质量,g/mmol
CaCO3的质量,g/mmol
5.允许差
平行测定两结果之差不大于0.20%。
十、食品中钙的测定方法
(一)原子吸收分光光度法
1.原理
样品经湿消化后,导入原子吸收分光光度计中,经火焰原子化后,吸收波长422.7nm的共振线,其吸收量与含量成正比,与标准系列比较定量。
2.试剂和溶液
要求使用去离子水,优级纯试剂。
2.1 盐酸。
2.2 硝酸。
2.3 高氯酸。
2.4 混合酸消化液 硝酸与高氯酸比为4∶1。
2.5 0.5mol/L HNO3溶液 量取45mL硝酸,加去离子水并稀释至1000mL。
2.6 2%氧化镧溶液 称取25g氧化镧(纯度大于99.99%),加75mL盐酸于1000mL容量瓶中,加去离子水稀释至刻度。
2.7 钙标准溶液 精确称取1.2486g碳酸钙(纯度大于99.99%),加50mL去离子水,加盐酸溶解,移入1000mL容量瓶中,加2%氧化镧稀释至刻度。贮存于聚乙烯瓶内,4℃保存。此溶液每毫升相当于500μg钙。
2.8 钙标准使用液 钙标准使用液的配制见表9-4。钙标准使用液配制后,贮于聚乙烯瓶内,4℃保存。
表9-4 钙标准使用液配制

3.仪器
所用玻璃仪器均以硫酸-重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷,后用水反复冲洗,最后用去离子水冲洗晒干或烘干,方可使用。
3.1 实验室常用设备。
3.2 原子吸收分光光度计。
4.测定方法
4.1 样品处理。
4.1.1 样品制备:微量元素分析的样品制备过程中应特别注意防止各种污染。所用设备如电磨、绞肉机、匀浆器、打碎机等必须是不锈钢制品。所用容器必须使用玻璃或聚乙烯制品,做钙测定的样品不得用石磨研碎。湿样(如蔬菜、水果、鲜鱼、鲜肉等)用水冲洗干净后,要用去离子水充分洗净。干粉类样品(如面粉、奶粉等)取样后立即装容器密封保存,防止空气中的灰尘和水分污染。
4.1.2 样品消化:精确称取均匀样品干样0.5~1.5g(湿样2.0~4.0g,饮料等液体样品5.0~10.0g)于250mL高型烧杯,加混合酸消化液20~30mL,上盖表皿。置于电热板或电沙浴上加热消化。如未消化好而酸液过少时,再补加几毫升混合酸消化液,继续加热消化,直至无色透明为止。加几毫升去离子水,加热以除去多余的硝酸。待烧杯中的液体接近2~3mL时,取下冷却。用去离子水洗并转移于10mL刻度试管中,加去离子水定容至刻度(测钙时用2%氧化镧溶液稀释定容)。
取与消化样品相同量的混合酸消化液,按上述操作做试剂空白试验测定。
4.2 测定 将钙、标准使用液分别配制不同浓度系列的标准稀释液如表9-5所示,测定操作参数如表9-6所示。
表9-5 不同浓度系列标准稀释液的配制方法

表9-6 测定操作参数

其他实验条件:仪器狭缝、空气及乙炔的流量、灯头高度、元素灯电流等均按使用的仪器说明调至最佳状态。
将消化好的样液、试剂空白液和各元素的标准浓度系列分别导入火焰进行测定。
5.分析结果的表述
5.1 标准曲线法 以各浓度系列标准溶液与对应的吸光度绘制标准曲线。钙标准曲线如图9-4所示,它的线性相关系数为0.9996。
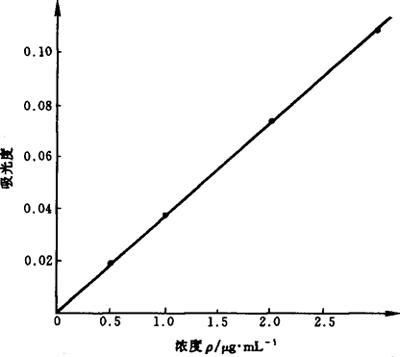
图9-4 钙标准曲线
测定用样品液及试剂空白液由标准曲线查出浓度值(ρ及ρ0),再按式(9-18)计算。

式中 x——样品中元素的含量,mg/100g
ρ——测定用样品中元素的浓度(由标准曲线查出),μg/mL
ρ0——试剂空白液中元素的浓度(由标准曲线查出),μg/mL
V——样品定容体积,mL
f——稀释倍数
m——样品质量,g
 ——折算成每百克样品中元素的含量,mg
——折算成每百克样品中元素的含量,mg
5.2 回归方程法 由各元素标准稀释液浓度与对应的吸光度计算出回归方程(也可以输入计算器得出回归方程),计算见式(9-19)。
ρ=ay+b (9-19)
式中 ρ——测定用样品中元素的浓度(可由计算器直接得出,μg/mL)
a——曲线斜率
y——元素的吸收度
b——曲线的截距
由回归方程或计算器得出测定样液及试剂空白液的浓度后,再由式(9-20)计算。

式中各符号的含义同曲线法说明。
5.3 结果的重复性 同实验室平行测定或连续两次测定结果的重现性钙小于10%。
最低检测限:钙0.1μg。
(二)滴定法(EDTA法)
1.原理
钙与氨羧络合剂能定量地形成金属络合物,其稳定性较钙与指示剂所形成的络合物为强。在适当的pH范围内,以氨羧络合剂EDTA滴定,在达到当量点时,EDTA就自指示剂络合物中夺取钙离子,使溶液呈现游离指示剂的颜色(终点)。根据EDTA络合剂用量,可计算钙的含量。
2.试剂和溶液
要求使用去离子水,优级纯试剂。
2.1 1.25mol/L KOH溶液 精确称取71.13g氢氧化钾,用去离子水稀释至1000mL。
2.2 1%氰化钠溶液 称取1.0g氰化钠,用去离子水稀释至100mL。
2.3 0.05mol/L柠檬酸钠溶液 称取14.7g柠檬酸钠(Na3C6H5O7·2H2O),用去离子水稀释至1000mL。
2.4 混合酸消化液 硝酸与高氯酸比为4∶1。
2.5 EDTA溶液 精确称取4.50gEDTA(乙二胺四乙酸二钠),用去离子水稀释至1000mL,贮存于聚乙烯瓶中,4℃保存。使用时稀释10倍即可。
2.6 钙标准溶液 精确称取0.1248g碳酸钙(纯度大于99.99%,105~110℃烘干2h),加20mL去离子水及3mL0.5mol/LHCl溶液溶解,移入500mL容量瓶中,加去离子水稀释至刻度,贮存于聚乙烯瓶中,4℃保存。此溶液每毫升相当于100μg钙。
2.7 钙红指示剂 称取0.1g钙红指示剂(C21O7N2SH14),用去离子水稀释至100mL,溶解后即可使用。贮存于冰箱中可保持一个半月以上。
3.仪器
所有玻璃仪器均以硫酸-重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷,后用水反复冲洗,最后用去离子水冲洗晒干或烘干,方可使用。
3.1 实验室常用玻璃仪器高型烧杯(250mL)、微量滴定管(1mL或2mL)、碱式滴定管(50ml)、刻度吸管(0.5~1mL)、试管等。
3.2 电热板 1000~3000W,消化样品用。
4.样品制备
同原子吸收分光光度法。
5.测定方法
5.1 样品消化 同原子吸收分光光度法。
5.2 测定。
5.2.1 标定EDTA浓度:吸取0.5mL钙标准溶液,以EDTA滴定,标定其EDTA的浓度,根据滴定结果计算出每毫升EDTA相当于钙的毫克数,即滴定度(T)。
5.2.2 样品及空白滴定:吸取0.1~0.5mL(根据钙的含量而定)样品消化液及空白于试管中,加1滴氰化钠溶液和0.1mL柠檬酸钠溶液,用滴定管加1.5mL1.25mol/LKOH溶液,加3滴钙红指示剂,立即以稀释10倍EDTA溶液滴定,至指示剂由紫红色变蓝为止。
6.分析结果的表述
样品中该元素的含量按式(9-21)计算:

式中 x——样品中元素含量,mg/100g
T——EDTA滴定度,mg/mL
V——滴定样品时所用EDTA量,mL
V0——滴定空白时所用EDTA量,mL
f——样品稀释倍数
m——样品称重量,g
7.结果的重复性
同实验室平行测定或连续两次测定结果的重复性小于10%。
本方法的检测范围:5~50μg。
注:作为食品添加剂的钙盐,有氯化钙、柠檬酸钙、甘油磷酸钙、葡萄糖酸钙、酸性焦磷酸钙、氢氧化钙、磷
酸二氢钙、磷酸氢钙、正磷酸钙、碳酸钙、乳酸钙、泛酸钙及硫酸钙,其含量计算如下:
氯化钙量=钙(%)×2.769
柠檬酸钙量=钙(%)×4.745
甘油磷酸钙量=钙(%)×5.243
葡萄糖酸钙量=钙(%)×11.188
酸性焦磷酸钙量=钙(%)×5.390
氢氧化钙量=钙(%)×1.541
磷酸二氢钙量=钙(%)×6.289
磷酸氢钙量=钙(%)×4.294
正磷酸钙量=钙(%)×2.590
碳酸钙量=钙(%)×2.497
乳酸钙量=钙(%)×7.692
泛酸钙量=钙(%)×11.890
硫酸钙量=钙(%)×4.296