试剂的选用和试剂溶液的配制
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第11页(7007字)
(一)试剂的分级、选用和保存 分析试剂一般分为六级:光谱纯、一级、二级、三级、四级及工业用试剂。光谱纯试剂(S.P.)为光谱分析用的标准物质。一级又称保证试剂(G.R.绿色标志),这种试剂纯度高,杂质含量低,一般作为标定剂和配制基准溶液之用。二级又称分析纯试剂(A.R.红色标志),适用于准确度较高的分析及配制标准溶液。三级又称化学纯试剂(C.P.蓝色标志),适用于一般常规分析试剂的配制。四级(L.R.实验室试剂蓝色标志)及工业用试剂含杂质较多,适于某些大量和精度要求不高的试剂配制。各级试剂价格可相差甚多,因之,不需要用更高一级的试剂就不要用;相反,有时经过检验,还可用较低级的试剂代替。例如经检验不含氨的四级及工业用的浓硫酸和氢氧化钠,也可用于全氮的测定。当缺乏二、三级试剂时,也可自行将低级试剂进行重结晶、蒸馏、升华等提纯制成。
试剂种类很多,贮存时应按酸、碱、盐类、指示剂、有机试剂、元素等分别存放。盐类中又可按阳、阴离子顺序排列存放。强酸、强碱、强氧化剂、易燃品和挥发性试剂应单独存放于荫凉、干燥、通风之处。氨水和HCl、HNO3极易挥发性药品,应远离其他试剂,以免被污染。定氮用的浓H2SO4和定钾用试剂尤须严防NH3的沾污,否则将引起分析结果的严重错误。启开氨水、乙醚等易挥发性试剂应特别小心,瓶口不要面对着人,防止试剂喷出发生事故。H2O2能溶解玻璃的碱质而加速分解,所以应用塑料瓶或涂腊的瓶贮存在暗处。70%的高氯酸与有机物接触易引起爆炸,稀释至50-60%则较安全,应用时亦是如此。氯化亚锡、硫酸亚铁等易被空气氧化的试剂,必须注意密封保存,防止吸湿等。氢氟酸有腐蚀性和毒性,除能腐蚀玻璃外,接触皮肤产生剧疼和灼伤,因此使用时要戴手套并在通风橱中进行。
(二)溶液浓度表示与溶液配制方法
1.体积比 液体试剂的体积与水的体积比例,如1∶3盐酸溶液,即1体积的浓盐酸与3体积的水混合。
2.重量比 固体试剂混合时,常用此法表示。例如,1∶9的CuSO4∶Na2SO4,即1份重量的CuSO4与9份重量的Na2SO4混合,粉碎过筛。
3.重量百分浓度,%(W/W) 100g溶液中含溶质的克数。例如,5%NaCl水溶液,即100g溶液中含5gNaCl和95g水。
4.体积百分浓度,%(V/V) 100ml溶液中含溶质的毫升数。例如,70%酒精,即100ml溶液中含70ml无水酒精和30ml水。
5.重量对体积百分浓度,%(W/V) 100ml溶液中含溶质的克数。例如3%的H3BO3溶液即3gH3BO3溶解于100ml水中。
6.摩尔浓度(mol) 1L溶液中含溶质的摩尔数。例如,0.2500mol EDTA二钠盐水溶液,即将372.3×0.2500=93.06gEDTA二钠盐溶于水后,加水稀释成1L(372.3为EDTA二钠盐的式量)。
7.当量浓度(N) 1L溶液中含溶质的克当量数。例如,0.4NH2SO4水溶液,即1L溶液中含0.4克当量的H2SO4。H2SO4的当量为98÷2=49,0.4克当量H2SO4为0.4×49=19.6g,而商品浓H2SO4的比重为1.84,含H2SO498%,故19.6gH2SO4为 浓H2SO4。配法:取浓H2SO410.9ml徐徐倒入水中,稍冷却后,加水至1L,如须精确的克当量浓度,则还须经标定,方法见后标准溶液的标定。
浓H2SO4。配法:取浓H2SO410.9ml徐徐倒入水中,稍冷却后,加水至1L,如须精确的克当量浓度,则还须经标定,方法见后标准溶液的标定。
8.ppm和ppb 百万分浓度和十亿分浓度。ppm是指1000g(或1L)溶液中所含溶质的毫克数,或1g(或1ml)溶液中所含溶质的微克(γ)数,如10ppm磷溶液,即1升溶液中含磷10mg,也即1ml溶液中含磷1μg。ppb是指1000g(或1L)溶液中溶质的微克数。
9.滴定度(T) 指每毫升滴定剂溶液相当于被测物质的克数。可用符号TM1/M2表示,M1是溶质的化学式,M2是被测物质的化学式。例如,TKMnO4/Fe=0.00503,表示高锰酸钾标准溶液对亚铁离子的滴定度,即每毫升KMnO4标准溶液可以氧化0.00503克亚铁离子。使用滴定度可消除系统分析误差。
10.百分浓度溶液配制的混合法则 混合两种已知浓度溶液以配制所需浓度(重量%)溶液的计算:如下图所示,将所须的溶液浓度(60%)放在两条直线的交叉点上,二个已知溶液浓度(85%和40%)放在二条直线的左端(较大的在上,较小的在下)。然后在每一条直线上,把两个数字的差(不计正负号)写在同一直线的右端,所得数字即要配制溶液需用的每一溶液的重量份数,即需用20份重量的85%溶液和25份重量的40%的溶液相混合。

如用溶剂稀释较浓的溶液以制备较稀的溶液,只需将左下角的浓度作为零即可。
(三)各种标准溶液的配制与标定
1.标准酸碱溶液
(1)0.1NHCl溶液:市售分析纯(A·R·)HCl比重为1.19,含HCl37.23%,当量浓度约为12。若需配制0.1N HCl1L,则0.1N×1000ml=12.0N×x,x=8.33ml,即量取浓HCl8.4ml,用水稀释至1L。
标定方法:称取硼砂(Na2B4O7·10H2O)(1)4.500-5.000g,加水溶解后,全部洗入250ml容量瓶中,定容,即加水至刻度,充分摇匀(上下摇动至少30次)。吸取硼砂溶液25ml,放入125ml三角瓶中,加水约至50ml,加入甲基红指示剂2-3滴,用0.1NHCl滴定至溶液由黄色转为微红色为终点,重复标定2-3次,平行标定结果的相对相差不得超过0.2%。
计算:
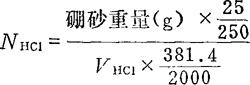
式中381.4是硼砂Na2B4O7·10H2O的式量。
(2)0.1NH2SO4溶液:市售分析纯H2SO4的比重约为1.84,含H2SO4约98%,当量浓度约为36。需配0.1NH2SO41L溶液时,
0.1N×1000ml=36N×xml,x=2.78ml。
可量取浓H2SO42.8ml,徐徐倒入约800ml水中,冷却后加水至1L。其标定方法与HCl同。
(3)0.1NNaOH溶液:固体NaOH易吸收空气中的CO2和水蒸气而生成Na2CO3和潮湿。Na2CO3与酸作用即生成CO2,将影响滴定终点的判断和测定的准确度。由于Na2CO3难溶于浓NaOH,所以较好的配法,是先将固体NaOH配成50%的浓溶液,密闭放置数天,待Na2CO3沉降后,取上面的澄清液使用。
配制时量取8.4ml50%NaOH澄清液放在烧杯中,用用无CO2的蒸馏水(新煮沸和冷却的蒸馏水)稀释至1L。
标定方法:称取4.000-5.000g预先在125℃烘干的邻苯二甲酸氢钾(KHC8H4O4),放入烧杯中用水溶解,然后洗入250ml容量瓶中定容。然后吸取25ml入125ml三角瓶中,再加30ml水,加2-3滴酚酞指示剂,用配制的NaOH溶液滴定至溶液呈粉红色,并在半分钟内不褪色为终点。重复标定2-3次,计算NaOH的当量浓度,要求相对相差不超过0.2%。
计算:

式中204.23是KHC8H4O4的式量。
标定NaOH也可以用草酸为基准物质。称量也可以分别称取三份,每份0.4000-0.5000g,作为平行测定。
2.氧化还原用标准溶液
(1)0.1NK2Cr2O7液:重铬酸钾由于易获得纯品,并且很稳定,所以是较好的基准物质。配制时,称取已在105-110℃烘干的K2Cr2O75.000g,加水溶解,然后全部洗入1L容量瓶中定容。其准确浓度可直接计算得到:
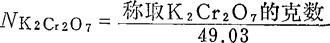
式中49.03是K2Cr2O7的当量。
(2)0.1N KMnO4液:称取分析纯KMnO43.2g,置于1L烧杯中,加入蒸馏水1L,加热近沸,并保持30min,或在室温下放置2-3d,使充分氧化水中的杂质,生成的MnO2沉淀后用玻璃棉过滤。滤液收集于棕色试剂瓶中,贮于暗处备用。
标定方法:标定KMnO4溶液的标定剂有Na2C2O4、H2C2O4·2H2O、FeSO4·7H2O、FeSO4·(NH4)2SO4·6H2O、As2O3和纯铁丝等,常用的是Na2C2O4。
称取在110℃烘干的分析纯Na2C2O4约1.000g,放入烧杯中,加水溶解,然后全部洗入250ml容量瓶中定容。用吸管吸取50mlNa2C2O4溶液放入250ml烧杯内,加6NH2SO410ml,加热到75-85℃,趁热用KMnO4溶液滴定。加入1滴KMnO4溶液搅动,待颜色褪去后,再继续滴定,随着反应速度的加快,逐渐增加滴定速度。直至滴定到加入1滴KMnO4溶液,经搅动后红色在1min内不褪去为终点。同时作空白试验,校正KMnO4溶液的用量。计算KMnO4的当量浓度。

式中0.06701是Na2C2O4的当量。
(3)0.1N FeSO4或0.1NFeSO4·(NH4)2SO4溶液:硫酸亚铁(FcSO4·7H2O)和硫酸亚铁铵〔FeSO4·(NH4)2SO4·6H2O〕都是浅绿色晶体,在空气中极易氧化为三价铁的碱式盐。因之标准溶液须经常标定。一般常测定亚佚溶液与氧化剂溶液的消定度,也可以计算亚铁溶液的当量浓度。
配制及标定方法:称取28克FeSO4·7H2O或40g FeSO4·(NH4)2SO4·6H2O于1L烧杯中,加500ml水及30ml 6N H2SO4,溶解后稀释至1L。用吸管吸取0.1N K2Cr2O7标准溶液10ml于250ml三角瓶中,加5ml浓H2SO4和5ml浓H3PO4,加水至约50ml,加2-3滴邻菲啰啉指示剂,用0.1NFeSO4·7H2O溶液滴定至溶液呈褐红色为终点。
计算:
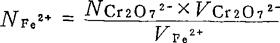
(4)0.1N KIO3溶液和I2溶液:配制0.1N KIO3溶液,则称取KIO33.600g,溶于适量水中,洗入1L容量瓶定容,倾入棕色试剂瓶贮于暗处。KIO3为基准物质,可直接计算其准确浓度。

式中214.002为KIO3式量。
配制0.1N I2溶液,可称取I26.5g及KI20g,加水溶解并稀释至1L。贮于玻塞棕色瓶中,放在暗处,数天后才标定。
0.1N I2的标定,从滴定管中放出20ml Na2S2O3标准溶液入250ml三角瓶中,加水至约100ml,加入淀粉指示剂1ml,用0.1N I2液滴定至溶液现稳定蓝色为终点。
计算:

(5)0.1NNa2S2O3溶液:称取25gNa2S2O3·5H2O,溶解于新煮沸而冷却的蒸馏水中,加入0.1gNa2CO3,稀释至1L。贮于棕色试剂瓶中,一天后标定。
0.1NNa2S2O2溶液的标定:称取K2Cr2O70.1000—0.1200g于500ml三角瓶中,加25ml水使溶解,加20ml4NH2SO4及10%KI溶液10m1,混匀,稀释至200ml,用0.1NNa2S2O3溶液滴定至黄绿色(I2为黄色,Cr3+为绿色),此时加入1%淀粉指示剂1m1,继续滴定至蓝色消失呈亮绿色为终点。并作空白试验。
计算:
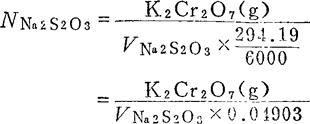
(6)0.05N K3Fe(CN)6液:称取分析纯K3Fe(CN)616.5g,Na2CO370g,溶解于水后,稀释至1L。用标准0.1NNa2S2O3标定。为此可吸取0.05NK3Fe(CN)6溶液50ml于250ml三角瓶中,加入KI3g和ZnSO4·7H2O3g,完全溶解后,再加9%醋酸10ml,用0.1N Na2S2O3标准液滴定至淡黄色,然后加1ml淀粉指示剂,继续滴定至溶液蓝色消失为终点。
计算:

3.沉淀滴定法用标准溶液
(1)0.1N AgNO3液:AgNO3系标定剂之一,可直接称量配制标准溶液。称取在110℃烘1-2h的分析纯AgNO317.00g(或纯银10.80g),溶于少量1∶1HNO3中,洗入1L容量瓶中定容。贮于棕色瓶中,保存在暗处。
计算:

也可用NaCl标定AgNO3。称取已在400-500℃灼烧至恒重的NaCl0.1500g入250ml三角瓶中,加25ml水使溶解,加入1ml5%K2CrO4溶液,在剧烈摇动下用AgNO3液滴定,至溶液刚摇动后仍呈浅砖红色为终点。
计算:

(2)0.1N KCNS液或0.1N NH4CNS液:硫氰酸钾和硫氰酸铵皆易吸湿,所以配制后须经标定。称取NH4CNS9g溶于1L水中,标定时吸取0.1NAgNO3标准液25ml入250ml三角瓶中,加入新煮沸冷却后无NO2的6N HNO33ml,再加铁铵矾指示剂1ml,在剧烈摇动下用NH4CNS溶液滴定,接近终点时,溶液显橙红色,经摇动仍不消失为终点。
计算:

铁铵矾指示剂:铁铵矾50g溶于100ml水中,加入浓HNO3直到溶液褐色消失和溶液澄清为止,贮于棕色瓶中。
4.络合滴定法用标准溶液
(1)0.01molEDTA液:称取分析纯EDTA二钠盐(C10H14O8N2Na2·2H2O)1.9g,溶于200m1温水中,稀至1L。标定时,准确称取金属锌约0.1500g放入250ml烧杯中,加1∶1HCl10ml,盖好表面皿,必要时微微加热,使锌完全溶解。然后全部洗入250ml容量瓶中,定容。计算其准确浓度。吸其锌溶液25ml入 250ml三角瓶中,滴加1∶1氨水至开始出现Zn(OH)2白色沉淀,再加pH10的缓冲溶液10ml,加水至约100ml,加约0.1g固体铬黑T指示剂,用EDTA液滴定至溶液由酒红色变为纯蓝色为终点。同时作空白试验。
计算:
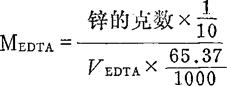
(2)pH10缓冲液:称取NH4Cl154g,加无CO2的水溶解,加比重0.9的氨水380ml,稀释至1L。
(3)固体铬黑T剂:称lg络黑T指示剂与100g NaCl混合,磨细备用。