比色分析基本原理
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第42页(1952字)
(一)有色化合物溶液显色原理 不同的溶液可显示各种不同的颜色,其原因是由于它们对光的吸收具有选择性。具有同一波长的光线,称为单色光。自然光是包含有多种波长组合而成的光线,称为混合色光,它是波长在4000-7500埃( )的电磁波,即由紫、蓝、青、绿、黄、橙、红等光按一定比例混合而成。例如蓝光与黄光可以混合为白光,这两种光色称为互补色。
)的电磁波,即由紫、蓝、青、绿、黄、橙、红等光按一定比例混合而成。例如蓝光与黄光可以混合为白光,这两种光色称为互补色。
当一束白光通过溶液时,如果溶液不吸收该波长范围内的任何光线,则溶液呈透明无色。如果溶液选择吸收了白光中某波段的光,则透射光中除白光外,还有白光中未被吸收的那一部分光,即被吸收的那个波段光的补色光,这就是溶液所呈现的颜色。例如黄绿色光与紫色光互补,MnO4-溶液具有选择吸收黄绿色光的特性,因此MnO4-溶液呈紫色。其浓度愈大,吸收的黄绿色光愈多,则透射光中紫色光部分愈占优势,即被“补”掉的愈少,因而呈现的紫颜色也就愈深。
如果溶液对多种波段的光都有吸收,则溶液的颜色也将是相应于几种被吸收光的补色光的混合色。如果溶液对白光中各种波长都是相当均匀地吸收,则溶液将呈暗灰色。
(二)朗伯—比尔定律 当一束单色光通过有色溶液时,由于溶液中溶质的原子或分子吸收了一部分光,光的强度就减弱,这种现象就是溶液对光的吸收作用。一部分光从溶液中透过,而有一小部分光被反射。所以入射光的强度I0应等于吸收光Ia、透过光It和反射光IR的总和,由下式表示:

如果比色杯规格不变,比色操作条件一致时,被反射光的强度是不变的。比色分析实际上是测量透过光强度的变化。透过光的强度与被测物质的浓度和有色溶液的厚度有一定关系。
根据朗伯定律:一定强度的单色光通过有色溶液时,若有色溶液的浓度一定,则入射光的强度和透过光的强度的比值的对数值与溶液的光径(厚度)成正比:
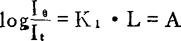
L——有色溶液的光径;
K1——比例常数;
 ——吸光度A,或称光密度D、消光值E。
——吸光度A,或称光密度D、消光值E。
又根据比尔定律:一定强度的单色光通过有色溶液时,若有色溶液的光径一定,则吸光度与有色溶液中被测物质的浓度成正比:
A=K2·C
C——有色溶液的浓度;
K2——比例常数。
合并上面朗伯-比尔两式则得朗伯—比尔定律:

式中K为吸收系数,对于某种有色物质在一定波长的入射光时,K为一定值。K值大小则随L及C的单位而改变,如果L以厘米,C以摩尔浓度为单位,则此常数称为摩尔吸收系数。
由朗伯—比尔定律可知:吸度A与被测物质的浓度C和溶液的光径L成正比。
(三)显色剂的选择 比色分析法要求较高的灵敏度和准确度,其重要条件是选择合适的显色剂,使被测物质生成稳定的有色溶液。一般生成有色化合物的化学反应主要有氧化还原反应、络合反应以及其它反应,其中以络合反应应用最广。元素的简单离子生成络离子后,常能吸收更多的光能,因而使该溶液呈现更深的颜色。例如二价铜离子(Cu2+)是蓝色、二价锰离子(Mn2+)是淡红色、三价铬离子(Cr3+)是绿色,而生成络离子后,颜色大大加深,如二价铜氨络离子〔Cu(NH3)42+〕是深蓝色、高锰酸络离子(MnO4-1)是深紫红色、铬酸络离子(CrO42-)是深黄色,因此可以提高反应的灵敏度。所以在比色测定中常常选择生成颜色较深的络离子。
有色络合物的吸光系数要大。其吸光系数愈大,比色测定的灵敏度就愈高。有色络合物的解离常数则要小,其解离常数愈小,络合物就愈稳定;络合物愈稳定,比色测定的准确度愈高,而且可以避免或减少其他离子的干扰。另外络合物的组成要恒定,最好具有一定的组成。组成发生变化容易引起色调的改变。显色剂的用量须保证有色溶液离子浓度的形成,同时标准溶液与未知溶液中显色剂浓度应一致,才能避免两个溶液中有色络合物的解离度不同所造成的误差。