甘蓝类
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第490页(9015字)
传统上,甘蓝类作物指芸薹属(Brassica)内植物,包括甘蓝,芥菜,茎椰菜,花椰菜,抱子甘蓝,萝卜和油菜。广泛栽培,适应于大多数气候。以中度寒冷气候环境最好。
(一)研究进展
育种目标视种而异。组织培养技术结合常规育种将使有些目标易于达到。例如,芸苔作物大都种植杂种(F1)品种,由二种自交不亲和亲本系经相互授粉产生。这种方法需工很多,还有自交亲本系难于保存。已证明组织培养适用于保存自交不亲和亲本系。
油菜(B.napus)含有不含需要代谢产物(芥酸,硫代葡糖甙和类固醇),限制它用于饲料或植物油。组织培养可从许多方式上予以解答:产生有需要特性的单倍体。异种或异属融合的细胞或转化细胞产生植株,饲用甘蓝(B.oleraceae)与饲用萝卜(Raphanus sativus)间人工杂种。这种杂种Raphanobrassica可能有Plasmodiphora病抗性。
有些甘蓝类作物受极端高或低温的不利影响;例如,在英国由于先作种子亲本的植株,在田间或移入温室后常遭寒害,难于培育秋花椰菜。组织培养技术能克服这种限制。
反之,远东大白菜生产受季节高温限制。育种目标是培育耐热、抗病和高产栽培品种。宜在热、湿季节期间选择种子亲本植株。大都甘蓝品种结实后死亡。选择能营养繁殖和连年保持的植株,将是有利的。
胚培养曾用于取得小白菜与大白菜杂交植株,甘蓝×油菜植株和甘蓝×大白菜植株。用其它方法不能得到这些杂种。取已受精的胚珠,进行离体培养。
原生质体可用于遗传工程和体细胞杂交。髓茎甘蓝原生质体产生了愈伤组织。油菜与大豆原生质体融合后,进行有丝分裂。油菜原生质体再生了植株。
花椰菜已观察到体细胞胚胎发生,可用于繁殖植株或取得无病毒植株。
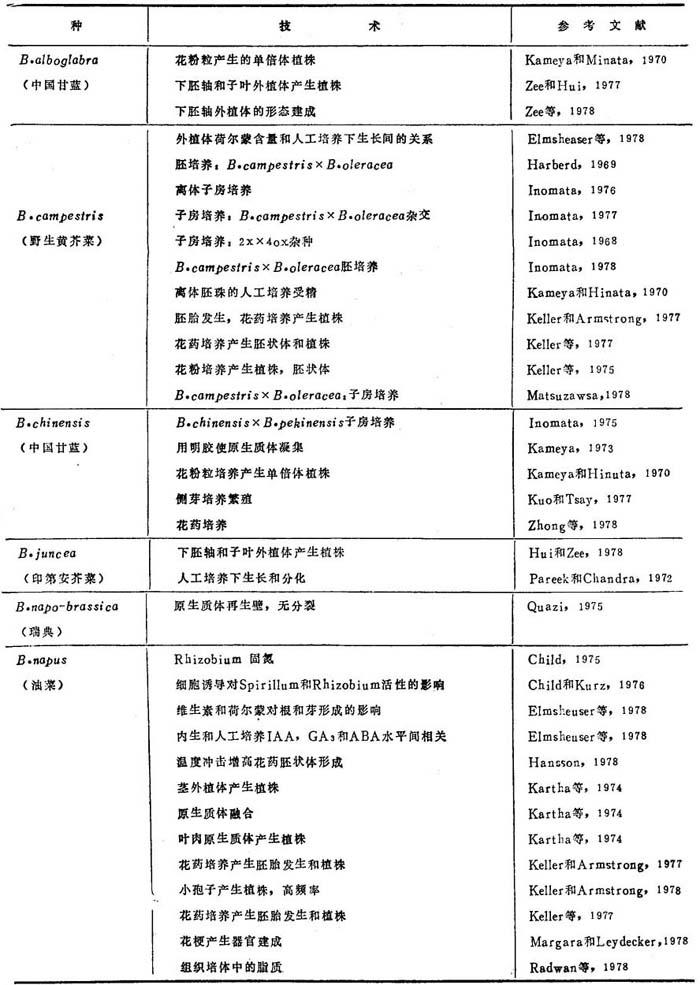
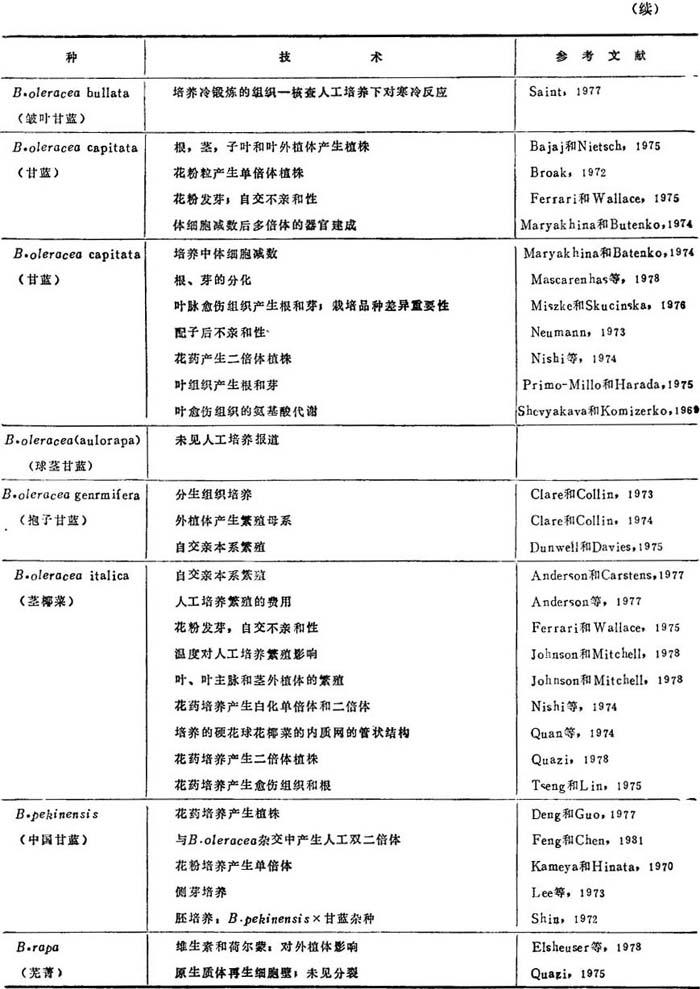
油菜花药或花粉培养取得单倍体,可用于产生同质系,野生黄芥菜和中国甘蓝也曾取得同样结果。繁殖自发产生的单倍体曾得到单倍体。芸苔作物组织培养方法繁殖,综列如表21-1,已报道的所用各种培养技术见表21-2。
表21-1 甘蓝类作物植株再生的组织培养方法

表21-2 甘蓝类作物培养技术

(二)培养程序
1.无性系再生:花椰菜
A.振荡培养(Walkey和Woolfitt,1970)
(1)将块状花序切成长40mm节段。
(2)15%次氯酸钠溶液表面消毒15min。
(3)将块状花序再切刈(直径3-7mm)。
(4)将块状花序转移到液体LS培养基附加KIN 12μM,IAA 45.6μM(每25ml培养基加一片,装在100ml三角瓶内)。
(5)培养在24-26℃,光周期16h。连续振荡80转/min。
(6)几天后将形成愈伤组织;3-4周后将产生根和芽。待根和芽充分发育后,再生植株可移栽土中。
B.固体培养(Buiatti等,1974)
(1)用16%商品漂白粉消毒curd 25min。
(2)切块状花序成小片。
(3)将小片接种在LS固体培养基+2,4-D 0.9μM+KIN 14μM,或BA 0.44μM+NAA5.4μM。
(4)培养在25±1℃,连续光照下。
(5)培养25天后,转移到不加2,4-D,但加KIN 23.2μM的LS培养基上,供芽和根分化。
C.体细胞胚形成(Pareek和Chandra,1978)
(1)用10%去垢剂溶液洗叶。切成小片,然后用5%次氯酸钠溶液消毒20min。
(2)把叶片切成小块,然后植板在MS琼脂培养基上,放在26℃和弱光下培养。
(3)培养基附加5.7μM IAA和2.3μM KIN。
(4)胚产生后,把愈伤组织块转移到0.05-0.5μM IAA的相同培养基上。
2.无性系再生:茎椰菜(Hui和Zee,1980;Johnson和Mitchell,1978)
(1)把无菌子叶、下胚轴和叶切成3.5mm小片。
(2)外植体培养在MS培养基附加IAA 46-51μM+KIN 14-28μM。有些栽培品种在附加粗制人参粉500-1000mg/l+NAA 2.6μM+BA 2.2μM或NAA 2.7μM+2ip 9.8μM分化较好。
(3)将培养试管放在27℃,扩散光(约2.5lx),16h日长。
(4)培养约1个月后,将产生再生植株。
3.无性系再生:汤菜(Clare和Collin,1974)
(1)用乙醇洗芽,在无茵培养皿上除去外部叶(叶柄要用10%次氯酸钙用力洗5分钟)。
(2)把内部叶切成厚片1.0-2mm,放在MS+2,4-D0.9μM+KIN 2.3μM培养基上。
(3)产生愈伤组织后,转移到MS+IAA 11.4μM+KIN 2.3μM和BA 44μM培养基上,启动芽和根。
(4)芽形成后,除去芽尖,以增多再生植株数。
(5)当再生植株高5cm根充分发育时,转至土中。
4.无性系再生 白甘蓝(Walkey等,1980)
(1)将分生组织切成直径0.5-2mm小片。
(2)把分生组织尖培养在MS+KIN 12μM培养基上,然后转移到MS+KIN 60μM诱导生芽。
(3)培养试管放在22±1℃,16h日长。
(4)为了诱导生根,把芽转移到无KIN培养基上。
(5)形成根后,再生植株移栽土中。
5.无性系再生 叶芥甘蓝(Hui和Zee,1978)
(1)从无菌种子长出的下胚轴和子叶。如果叶外植体,先浸入70%乙醇30s,然后放入20%Clorox+0.1%吐温20。
(2)外植体(直径3-5mm)培养在MS+NAA 2.7μM+KIN 8.9μM或NAA 2.6μM+BA8.8μM培养基上。
(3)培养试管放在27±1℃,日长16小时。
(4)培养30-40天后将形成再生植株;移栽土中。
6.无性系再生 中国甘蓝(Kuo和Tsay,1977)
(1)用75%乙基酒精表面消毒侧芽1.5min,10%次氯酸钠10分钟。
(2)培养在MS+BA 0.44μM+NAA 5.4μM培养基上。
(3)2周后将生根。形成再生植株后,移土中。
7.杂种胚培养(Feng和Cheng,1981)
(1)用普通甘蓝(B.oleracae,2n=18)为母本,中国甘蓝(B.pekinensis,2n=20)为父本。
(2)从授粉后30-40天的种子荚取出幼胚。
(3)培养在WH培养基上,诱导愈伤组织形成。
(4)把愈伤组织转移到B5培养基上,诱导芽和根形成。
(5)形成再生植株后,将杂种再生植株栽于钵中。
8.花药培养 从硬花球花椰菜再生二倍体植株
许多学者培养芸薹作物花药再生植株最近取得成功。单倍体花粉有再生单倍体植株能力,由此可发育成新品种。
中国甘蓝花药培养再生植株(Deng和Guo,1977):
(1)从0.2-0.4厘米花芽取出花药。
(2)花药培养在Nitsch+2,4-D 9μM培养基上。25-30天后将形成愈伤组织。
(3)愈伤组织转移到分化培养基上,用Nitsch培养基+IAA2.8μM+KIN2.3μM,蔗糖浓度降到1-2%。
9.原生质体培养 采用油菜原生质体再生方法,最近提出了B.oleracae原生质体再生方法。原生质体方法学的进展,很适用于产生新奇遗传组合,以创造新品种。
原生质体分离,培养和再生:Brassica spp.(Xu等,1982)
(1)Brassica alba,B.campestris,B.oleracea和B.napus种子放入0.1%(w/v)氯化汞和0.1%(w/v)Sodium lauryl sulfate表面消毒,无菌蒸馏水淋洗3次,放在0.6%琼脂+0.2%蔗糖上发芽,暗培25℃。
(2)2天内,切取长1厘米根尖,如有足够长度,加以横切。
(3)根切片放在0.71M甘露糖醇+KH2PO4 0.19mM+KNO3 1.0mM+CaCl2·2H2O10.1mM+MgSO4·7H2O0.98mM+KI0.96μM+CuSO4·4H2O0.01μM,pH5.6(CPW溶液)上1h,质壁分离。
(4)质壁分离后,根切片放在CPW溶液中加2%Rhozyme,4%Meicelase和0.3%Macerozyme。培养条件16h光照,25℃,振荡50rpm。
(5)原生质体制品经64μm尼龙过滤膜过滤纯清,继之离心100×g10min。
(6)离心产生的片状沉积原生质体,再悬浮在CPW十蔗糖0.61M代替0.71M甘露糖醇,离心100×g5min。收集浮在蔗糖上的原生质体,用CPW+0.71M甘露糖醇培养基洗2次。
(7)原生质体再悬浮在培养基中(改进的Kao和Michayluk,1975),暗培14天。
(8)每隔7-10天加新鲜培养基。
(9)30-45天龄愈伤组织克隆转移到B5琼脂培养基+蔗糖0.087M+2,4-D 4.5μM+BA 4.4μM。
(10)在B5上2-3周后,愈伤组织转移到MS+IAA 11.0μM+BA 4.4μM,以备芽再生。
(三)展望
大多数重要芸苔作物已具备了组织培养技术(表21-3)。作者认为应适当考虑影响其再生植株成功的二种关键可变因素:第一,芸苔作物的植株再生频率差异大;第二,一个种内诸栽培品种间植株再生能力常有相当差异。可是,最近发现用附加人参糖的培养基,这些问题得以部分解决。
表21-3汇综人参粉对某些芸薹属作物植株再生频率增高的效果。
表21-3 人参对某些甘蓝类作物植株再生的效果

【参考文献】:
〔1〕Dunstan,D.I.and K.C.Short 1977 Improved growth of tiSsue cultures of the oniun,Allium cepa.Physiol.Plant,41:70-72.
〔2〕Havra′nek,P.and F.J.Novak 1973 The bud formation in the callus caltures of Allium sativum L.Z.Pflangenphysiol.68∶308-318.
〔3〕Hussey,G.and A.Falavigna 1980 Origin and Productiom of invitro adventitious shoots in the Onion,Allium cepa L.J.Exp.Bot.31∶1675-1686.
〔4〕Jones,H.A.and L.K.Mann 1963 Onions and their allo′es-Botany,Caltivation and Utilization,Leonard Hill,London Interscience,New York.
〔5〕Koul,A.K.,R.N.Gohil and A.Langer 1979 Prospects of breeding improved garlic in the light of its genetics and breeding systems.Euphytica 28∶457-464.
〔6〕Novak F.J.1980 Phenotype and cytological status of plants regenerated from cellus Cultures of Allium sativum L.Z.Pflanzenzueht.84∶250-260.
——1981 Chromosomal characteristics of long-term callus cultures of Allium sativum L.Cytologia 46∶371-379.
——,L.Hayel and J.Dolezel 1982 In vitro breeding system of Allium.In∶Plant Tissue Culture 1982(A.Fujiwara,ed.)pp767-768,manuzen,Tokyo.
〔7〕Clare,M.V.1974 The production of plantlets from tissue culture of brussel sprout(Brassiea oleracea var.Gemmifera D.C.)Atnn.Bot.38∶1067-1076.
〔8〕Gatenby,A.A.and E.C.Cocking 1977 Callus formation from protoplasts of marrow stem kale.plant Sci Letter 8∶275-280.
〔9〕Grout,B.W.W.and P.Crisp 1977 Pratical aspects of the propagation of cauliflower by meristem culture.Acta Hortic.72∶289-296.
〔10〕Johnson,B.B.1978 In vitro propagation of braecoli from stem,leaf and leaf rib explants Hortscience 13∶246-247.
〔11〕keller,W.A.1978 High frequency production of microspore derived plants from Brassica napus anther cultures.Z.Pflaryenzüecht.80∶100-108.
〔12〕Xu,Z.H.,M.R.Dowey and E.C.Cocking 1982 Plant regeneration from root protoplasts of Brassica.Plent Sci.Lett.24∶117-121.
〔13〕Zee,S.Y.,S.C.Wu,and L.H.Hui 1980 Rosearch on tissue calture explant morphogenesis and the enhancement effect of some chinese drugs on explants a summary report.Acta Physiol.sinica 6∶419-423.
〔14〕Al-Abta,S.and H.A.Collin 1978 Control of embryoid development in tissue ualture of eelery Ann.Bot.42∶773-782.
〔15〕Merrick,M,M.A.and H.A.Collin 1980 Selection for asulam resistance in tissue cultures of celery,Apium graveolens L.var.Dulce cv.New Dwarf White PIant Sci.Lett.20∶291-296.
〔16〕Sims,W.L.,J.E.Welch,and V.E.Rubatzky 1977 Celery production in California.Leaflet 2673,Cooperative Extension,Division of Agricultural Scie-nce,Univ,of California,Berkeley.
〔17〕Williams,L.and H.A.Collin 1976 Embryogenesis and plantlet formation in tissue cultures of celery.Am.Bot.40∶325-332。