有溶液参与反应的热力学计算
出处:按学科分类—数理科学和化学 东北大学出版社《无机物热力学数据手册》第12页(4467字)
上节的计算实例都是在以拉乌尔定律为依据来处理溶液而得到的式(58)至式(72)的基础上进行的,各物质的标准态都是纯物质,计算时不涉及标准态的转换,但必须将浓度换算为摩尔分数。但实际应用中却很少使用摩尔分数,特别是涉及到溶质参与的化学平衡计算,经常使用质量百分浓度和其他浓度。这就出现了以亨利定律为依据来处理溶液,对标准态作适当转换的另一种计算方法。
1.以亨利定律为依据的溶质化学势表达式及其标准态
仿式(56)至(58)的处理方法,可得到溶质Bi服从亨利定律时的化学势为

式中ci是Bi的浓度;由于ci有单位,而取对数时不能带单位,所以引入cθ。cθ称为标准浓度,其数值为1,其单位与ci的单位相同。例如ci代表质量摩尔浓度m时,cθ写成mθ,其值为1mol·kg-1;ci代表体积摩尔浓度时,cθ之值为1mol·dm-3;当ci代表质量百分数(%i)或摩尔分数(xi)时,由于这两种浓度都是无量纲的,cθ的值为1。
Bi不服从亨利定律时,式(73)中的ci/cθ亦可用活度ai代替,得到
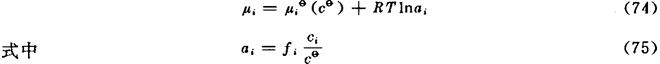
ai是Bi的活度,fi是Bi的活度系数。fi>1表示对亨利定律呈正偏差;fi<1则呈负偏差;fi=1表示Bi服从亨利定律,这时ai=ci/cθ。
式(74)和式(73)中的μiθ(cθ)是标准化学势。标准态就是ci=1的服从亨利定律(fi=1)的溶液。标准态的ci和fi均为1;标准态的活度值也为1。
由于ci可以采用不同的浓度单位,故有不同的标准态。例如:
当浓度用摩尔分数xi表示时,标准态就是将亨利定律直线延长到xi=1处的假想状态。这时,式(75)写成
ai=∫ixi (75a)
当浓度用质量百分数%i表示时,标准态乃是亨利定律直线上浓度为1%的状态,也就是服从亨利定律的1%溶液(通常简称为1%溶液)。这时,式(75)写成
ai=fi〔%i〕 (75b)
当浓度用摩尔百分数mol%i表示时,标准态便是亨利定律直线上xi=0.01处的状态,也就是服从亨利定律的xi=0.01溶液。这时,式(75)写成
ai=fi〔mol%i〕 (75c)
当浓度用质量摩尔浓度表示时,标准态则是亨利定律直线上mi=1的状态,也就是服从亨利定律的mi=1的溶液。这时,式(75)写成

以上四式中的ai及fi在数值上都是各不相同的。但当溶液变稀时,四式中的fi值都趋于相同。这时fi与γi的关系是
γi=γi°fi (76)
式中γi°是以纯Bi为标准态含Bi无限稀时的活度系数,即

2.标准溶解自由能
恒温下,组元Bi溶解过程的标准吉布斯自由能变,称为Bi的标准溶解自由能,以△Giθ表之,即
Bi=〔Bi〕 △Giθ
△Giθ是〔Bi〕的标准化学势与纯Bi的化学势之差,其值与〔Bi〕的标准态有关:
1)当〔Bi〕的标准态是纯Bi时,△Giθ=0,〔Bi〕的活度用ai=γixi计算。 即式(61)。
2)当〔Bi〕的标准态是将亨利定律直线延长到xi=1的假想状态时,
Bi=〔Bi〕x △Giθ=RT1nγio (78)
〔Bi〕的活度用ai=fixi计算,即式(75a)
3)当〔Bi〕的标准态是亨利定律直线上浓度为1mol%(即xi=0.01)的溶液时,

〔Bi〕的活度用ai=∫i〔mol%i〕计算,即式(75c)。
4)当〔Bi〕的标准态是亨利定律直线上浓度为1%的溶液时,

式中Mi和M1分别代表溶质Bi和溶剂B1的摩尔质量。这时活度用式(75b)计算,即ai=fi〔%i〕,不必将〔%i〕换算为xi。所以,这种标准态在实际工作中得到广泛应用,但在计算△Gθ和Kθ时,要计入标准溶解自由能(参见下例)。
本书表3-2和表3-3中列出了1600℃的铁液和1200℃的铜液中某些溶质的标准溶解自由能(以1%溶液为标准态)。
〔计算实例〕 已知1873K的铁液中含钒为0.08%,采用1%溶液为标准态,计算下列反应的Kθ和平衡氧分压:
2〔V〕%+3/2O2=V2O3(s)
若po2=101.3kPa,求反应的△G。
此例和上例(见11页)的条件相同,算法不同,但结果应相同。
由表2-3和表3-2查得:

对以上二反应作线性组合(1)-2(2)得

在T=1873K时,△G3θ=-545.7kJ·mol-1

铁中含钒很低,可认为服从亨利定律,所以fv=1,av=fv〔%V〕=0.08

将K3θ=1.66×1015,av=0.08,av2o3=1代入上式,可求得po2/pθ=2.07×10-9
∴ po2=2.07×10-9×101325=2.10×10-4Pa
当po2=101.3kPa时

以上二例算出的平衡氧分压及△G均相同,但Kθ和AGθ却不同。这是由于〔V〕标准态不同所造成的。
3.相互作用系数
设B1代表溶剂,B2,B3,……,Bm代表各溶质,则当溶液较稀(xi→1)时,溶质Bi的活度系数γi与浓度的关系是

εij称为溶质Bj对Bi的一阶相互作用系数;εii称为Bi自身的一阶相互作用系数。
当Bi的浓度用质量百分数时,对fi亦有类似的关系:

eij亦称为溶质Bj对Bi的一阶相互作用系数;ei1称为Bi自身的一阶作用系数。
本书表3-4和表3-5中列出了铁液中某些元素的一阶相互作用系数。若知道溶质的浓度,由表中查出相互作用系数后,便可依式(81)或式(82)求出活度系数。
〔计算实例〕 已知铁基合金中溶质的浓度为xsi=0.008,xM0=0.01,xcr=0.013。求在1873K及pN2=101.3kPa下合金中平衡含氮量〔%N〕
首先求氮的活度系数fN。由表3-4查得: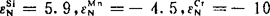 ,
,
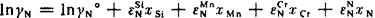
考虑到 和xN均甚小,上式最后一项可以忽略不计。代入上述数据,并应用式(76),得
和xN均甚小,上式最后一项可以忽略不计。代入上述数据,并应用式(76),得

fN=0.88
其次,求平衡的氮活度和氮浓度,查表3-2得

T=1873K时,△Gθ=48346J·mol-1
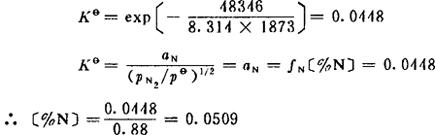
〔计算实例〕 用CaS作固体电解质构成电池测定铁液中的硫活度时,CaS会被铁液中的氧所氧化
CaS(s)+〔O〕=CaO(s)+〔S〕
已知铁液中含有0.65%C和0.052%S,求在1900K,铁液中允许的最大氧含量〔%O〕和氧活度是多少才不致发生上述反应。
首先,由表2-3中数据算得下反应的△GO:
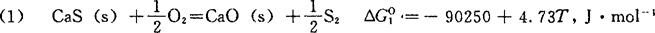
其次,由表3-2查得:

进行线性组合(1)-(2)+(3)得:

T=1900K时,△G4θ=-49165J·mol-1
再由表3-5查得: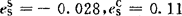 ,
, ,
, ,
, ,
, 。
。
在反应(4)中,acas=1,acao=1,所以

取对数
lgK4θ=lgfs+lg〔%S〕-lgfo-lg〔%O〕 (a)
上式中各项可以分别由已知数据求得:

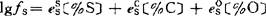 =-0.028×0.052+0.11×0.65-0.27〔%O〕=0.070-0.27〔%O〕
=-0.028×0.052+0.11×0.65-0.27〔%O〕=0.070-0.27〔%O〕
l =-0.133×0.052-0.45×0.65-0.20〔%O〕=-0.299-0.20〔%O〕
=-0.133×0.052-0.45×0.65-0.20〔%O〕=-0.299-0.20〔%O〕
将以上各项及〔%S〕=0.052代入式(a),整理后得
lg〔%O〕+0.07〔%O〕=-2.266
解之得允许的最大(平衡)含氧量为
〔%O〕=0.0054
将此值代回lgfo=-0.299-0.20〔%O〕中,求得fo=0.501
∴ ao=0.501×0.0054=0.0027