麻风动物模型的应用
出处:按学科分类—医药、卫生 科学普及出版社《麻风病实验室工作手册》第142页(11703字)
一、麻风病原学的研究
由于麻风杆菌迄今未能人工培养成功,因此阻碍了对麻风病原学的研究。小鼠足垫感染模型的成功及多菌型(MB)模型的发展,为进行此项研究工作提供了有效方法。
(一)测定麻风杆菌生活力
目前,主要应用免疫正常小鼠足垫感染模型来测定,以ML在足垫中的增殖情况作为判断菌生活力的依据。
置ML悬液于不同环境条件下,可检验各种物理、化学因素对ML生活力的影响。鼠足垫实验结果已经证明不同温度、日光、紫外线、体外干燥环境和各种化学物质对ML生活力的影响(参见第一章),这些研究成果有助于了解ML的生物学特性,从而掌握保存ML活力的要求及杀灭菌所需条件的科学依据,对深入了解麻风病的流行病学也有一定的意义。
(二)鉴定人麻风杆菌
ML在免疫正常小鼠足垫中的生长模式是特异的,许多分枝杆菌在足垫中并不生长;溃疡分枝杆菌和海鱼分枝杆菌虽可在足垫中增殖,但接种后局部产生肿胀、潮红,伴有肉芽肿浸润和坏死;鼠麻风分枝杆菌生长较ML快,接种鼠足垫后迅速增殖,70天后的世代时间为4.5天,且局部明显肿胀,肝、脾组织切片中有许多小的菌集落。MB动物模型如裸鼠足垫中增殖的AFB,将其菌悬液接种免疫正常的小鼠足垫,能复现典型的人麻风杆菌生长特点。因此,鼠足垫实验可作为新的麻风动物模型是否成功以及体外人工培养出的AFB是否为人麻风菌的鉴定试验。
(三)麻风杆菌的来源和菌种保存
MB动物模型可提供大量的菌源,如感染犰狳的每克肝组织中可含10亿(109)条ML;裸鼠的感染足垫中菌量可高达5×1010/足垫,这使需高菌量的研究工作得以开展。ML能在易感动物体内反复传代,其生物学特性保持稳定,因此,利用此特点可保留菌种。
(四)评价菌苗效果
Shepard曾用鼠足垫感染模型进行了死麻风菌苗、卡介苗及二者混合菌苗保护效果的比较研究,结果表明,混合菌苗比单用一种菌苗的效果好;皮内接种比皮下接种途径能发挥更大的保护作用。这些研究工作为近几年开展的麻风现场使用混合菌苗的免疫预防研究提供了依据。预期新的麻风菌苗的研制,在进入麻风现场试验之前,运用麻风动物模型评价效果将是不可缺少的一项工作
二、麻风实验化疗研究
目前,ML对特异性化疗药物的反应主要是根据在动物体内的研究结果。现将同实验化疗有关的问题分述如下:
(一)麻风实验化疗中常用的实验动物的特点
1.免疫正常小鼠
(1)质量好的、对ML易感的纯种鼠和杂交鼠均可采用,因此动物来源很广。
(2)容易保持清洁。
(3)动物饲养花费少,占空间小,成本低廉。
(4)接种菌量低,一般为5.0×103~1.0×104。
2.免疫抑制的T/R(切除成年小鼠胸腺后给予X射线照射)小鼠
(1)不能采用外购的小鼠,必须使用清洁动物房繁殖的小鼠。
(2)要有放射线照射来源。
(3)动物需饲养在清洁动物房内,要同普通小鼠分开。饲养费用并不高于普通小鼠。
(4)接种菌量可采用105/足垫,也可进行静脉接种。
(5)ML在T/R小鼠体内增殖一致。
3.新生期摘除胸腺的路易斯大白鼠(NTLR)
(1)不能使用外购的大鼠,必须选择新生期同窝的动物;但可购买怀孕的大白鼠。
(2)若饲养环境为清洁动物房,动物存活率可提高。
(3)饲养场所比小鼠的大。
(4)每足垫最高接种菌量为106,也可采用静脉途径。
(5)NTLR由于免疫缺陷程度不同,菌增殖也有差异。
4.先天性无胸腺小鼠(裸鼠)
(1)动物要饲养在SPF条件下,所需费用较大,饲养和管理的技术水平要求也高。
(2)笼具不比正常小鼠的大,但饲养用的隔离器设备,需占很大空间。
(3)最高接种菌量为107~108条菌/足垫,也可取其它途径接种。
(4)菌在动物体内增殖一致。
(二)筛选抗麻风药物常用的几种方法
迄今为止,鼠足垫感染模型仍被认为是筛选抗麻风药物最方便和可靠的模型而被广泛使用,现已确认的抗麻风有效药物均在此动物模型中显示抑菌或杀菌活性。在实验化疗中,通常选用免疫正常小鼠,因为此类动物遗传性一致,实验稳定,花钱少,来源也广。
ML可采自未经治疗的MB病人皮损部位,或从已感染的小鼠足垫中及感染动物的组织中取得。进行药物初筛时,要用动物的最高耐受剂量,若用低剂量,实验结果证明无抗菌活性,仍不能确定药物有没有作用。目前筛选抗麻风药物有三种基本方法,现介绍如下:
1.连续法 从小鼠感染之日起给药,一直持续到实验结束。一般在小鼠接种ML后3~5个月,先检查未治疗组(对照组)动物足垫中菌量,发现菌肯定增殖即从接种103.7~104.0/足垫至少增至105.7(50万)条时,立即对治疗组和对照组小鼠的足垫进行菌计数。如果连续2次,其间相隔一个月,然后两组进行比较,若菌量相同或接近则定为无效;治疗组小鼠足垫中菌量低于对照组为部分有效;明显低于对照组则定为有效。
连续法可测定药物的最低有效剂量(MED)。实例见表4-1。测定方法是通过给予一系列不同浓度的药物或药物饲料,并观察它们对ML的作用。表4-1是用5株ML进行了丁氨苯硫脲的敏感性试验。每只小鼠的一只后足垫接种104条菌,并于接种之日起给实验组喂以含药物的饲料。对照组为20只小鼠,喂食不含药物饲料。实验组每组5只小鼠。在接种后3个月开始,每月剖杀4只对照组小鼠,自接种足垫进行菌计数。6个月后,当足垫的平均菌量达到105.7~106.0条时,剖杀实验组小鼠作足垫菌计数,检测MED。
表4-1 连续法测定丁氨苯硫脲对麻风杆菌MED※※※

※ 接种麻风菌后6个月治疗组小鼠足垫平均菌数
※※ 接种麻风菌后6个月对照组小鼠足垫平均菌数
※※※ 引自Colston MJ.等:Lepr Rev 1978;49(2)∶101
连续法能证实药物的抗ML活性,也是检测药物最低抑菌浓度(MIC)必须采用的方法。因为MIC是用药物MED治疗的小鼠血浆中相应药物浓度(检测方法取决于药物的性质)。此法也能判断联合用药的抗ML效果,是协同作用还是相互拮抗。连续法的缺点是不能区别是抑菌或是杀菌作用。另外,实验所需用药量大,药厂提供常有困难。特殊合成的化合物,可能成本很高。
2、动力法 能判断一种化合物抗ML活性是抑菌还是杀菌作用,采取先感染后给药的方法。ML感染小鼠足垫后到菌对数生长早期或中期才给药,大约在小鼠接种ML60天或70天之后投药。通常给小鼠服药60天,根据实验需要,小鼠服药时间可以延长,在不喂药的对照组小鼠中定期检查鼠足垫中菌量,若发现菌出现增殖,立即停止给药,对照组和治疗组小鼠同时进行足垫菌计数。以后常间隔28天或56天作足垫菌计数一次,直到治疗小鼠足垫的平均菌量增殖到106.0~106.3/足垫或无剩余小鼠为止。将各组历次的足垫平均菌数绘制成ML的生长曲线。比较治疗组和对照组到达105.7~106.0/足垫时间,其差值即治疗组ML推迟生长天数。测定推迟菌生长天数应在菌对数生长后期,因为在对数生长早期,足垫中菌量较少以及每足垫菌数可能会发生较大的取样误差,若治疗组的足垫平均菌数始终未达到105.7~106.0,则以最后一次足垫菌数为起点,计算按对照组对数期世代时间这一速度增殖到105.7~106.0条菌所需时间,在推算得到的推迟生长天数的前面可加“>”符号表示,见表4-2。
表4-2 环戊基哌嗪力复霉素(R-77-3)及利福平(RMP)杀麻风菌作用的比较※

※ 王荷英等:临床皮肤科杂志,1986;3,121
※※ 对照组小鼠足垫中麻风杆菌对数生长期世代时间为8.96天(快株)。
※※※ 小鼠服药70天。
如推迟生长时间仅相当于投药时间与停药后药物排空所需时间之和,则认为治疗方案仅有抑菌作用;停药后未见ML增殖,则认为有杀菌作用;若超额推迟生长时间(推迟生长时间超过投药时间与停药后药物排空所需时间之和)很长则称为杀菌型作用,理论上可认为治疗导致(1)菌已被杀死;(2)细菌生长停顿(bacteriopause)或延期抑菌作用,即药物对细菌产生可逆性损伤,药物排空后菌还需要经过一段修复损伤的时间才能恢复正常生长增殖能力。因此,根据动力法能够区别单纯抑菌和杀菌型作用,但是不能区分细菌生长停顿与杀菌作用,除非在停药后,细菌完生不能增殖。
杀菌率计算:先算出菌的世代时间(G),其公式为:

例:麻风杆菌世代时间为15天,某药物推迟生长60天,则推迟4代:

logX=2-4×0.3010=0.796
X=6.25
杀菌率(%)=93.75%
应用动力法,给小鼠分组服等级剂量药物,可测定抗麻风药物的最低杀菌剂量(MBD)和最低杀菌浓度(MBC)。MBC是由MBD喂食时所得到的相应血浆药物浓度。
在小鼠药物筛选中,各实验室所取得的研究结果,有时会出现一些矛盾,这是由于每个实验室所应用的麻风菌株不同,这些菌株是来自不同的病人。因此,将单一菌株的研究结果应用到所有菌株时,必须谨慎。
3、比例杀菌法(proportioanl bactericide method)是近年发展的一种评价药物抗麻风效果的方法,是检测药物杀菌作用最可靠的方法。
研究方法:用常规方法制备成菌悬液,使每0.03毫升接种液中含有103.7~104.0条/ML,并以10倍系列稀释的ML,使最终稀释的接种液每0.03毫升中含5或10条菌,即分为104、103、102和101条/菌4个接种小组。通常对照组和治疗组都包括相同数量接种小组,每组稀释液接种5~10只小鼠。治疗组的动物往往在接种当天喂以药物饲料,持续1~60天后改用正常饲料,随药物而定。感染后12~18个月逐个取足垫作菌计数,因为从理论上讲,在此期间,足以使一条活菌增殖到106条。在至少一年的实验期结束时,凡足垫菌量≥105条菌,则确定为ML已增殖。根据各组不同接种菌量小鼠中出现ML增殖小鼠的比例,求得导致上述结果的最大可能活菌数/104条菌(MPN),停药时,根据鼠足垫中ML的存活率以及治疗过程中ML半衰期即有活力菌减少一半所需时间( ),从而判断出特定剂量药物有无杀菌作用及其杀菌强度。计算方法如下:
),从而判断出特定剂量药物有无杀菌作用及其杀菌强度。计算方法如下:
(1)MPN:根据每组连续3个等比级数接种菌量小组出现ML增殖的比例从专用表中查找MPN※。前题是各小组的结果能转换为分母是5或10而分子须为整数的数值,否则需按公式

=a1n1+a2n2+a3n3(1)计算式中a、p、n、都是已知数。a1、a2和a3是连续3个等比级数接种菌量的比值,如较高浓度为10、中间浓度为1、较低浓度为0.1表示,P1、P2和P3分别代表3种接种菌量小组出现麻风菌增殖的小鼠数;n1、n2和n3分别代表3种接种菌量小组作足垫数菌小鼠数。求得的X值即为中间浓度接种菌量所含最可能活菌数,通常换算为每104条接种菌中的活菌数,即为MPN。比例杀菌试验采取4个等比级数的接种菌量,实际计算MPN时只选用连续3个等比级数接种菌量小组的数据,其选择原则如下:
1)如有1个以上接种菌量小组的小鼠全部出现阳性结果,计算MPN时只选用稀释度较高组的数据,104和103接种菌量小组均全部阳性,实际计算时只选用103,102和101小组的数据。
2)如1个以上接种菌量小组的小鼠全部为阴性,计算MPN时只选用稀释度较低的数据,如103、102和101小组均未出现菌增殖,计算MPN时仅选用104、103和102小组的数据。
3)如4种接种菌量小组数据无法根据以上原则选用3个小组的结果计算MPN,则分别根据连续3个等比级数接
种菌量小组的数据求得两个MPN值,其平均值即为全部的MPN。
(2)停药时足垫中ML的存活率:以对照组MPN作为100%,各治疗组MPN与对照组MPN的比值,即为停药时ML的存活率。
(3) :假设在杀菌药物作用下ML的存活率以指数形式下降,在以后存活率的对数值为纵座标,疗程为横座标的座标纸上,可求得存活率下降50%的时间即
:假设在杀菌药物作用下ML的存活率以指数形式下降,在以后存活率的对数值为纵座标,疗程为横座标的座标纸上,可求得存活率下降50%的时间即 。
。 越短,杀菌效果越好。比例杀菌试验测定举例如下(表4-3):
越短,杀菌效果越好。比例杀菌试验测定举例如下(表4-3):
表4-3 比例杀菌试验测定各种药物对麻风杆菌的杀菌作用※
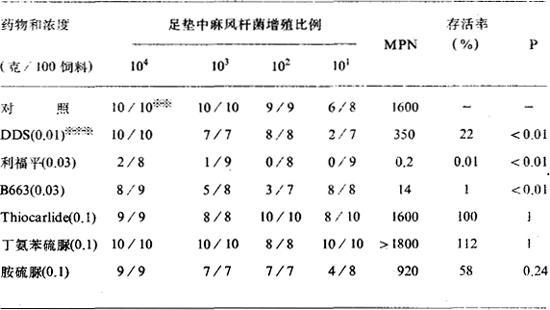
※ 引自Colston等∶Lepr Rev 1978;49(1)∶7
※※ 出现菌增殖的足垫数
※※※ 服药60天P值:与对照组比较
比例杀菌法是Colston等针对动力法的不足而特地设计的一种试验方法。但是,此方法比其它方法需要更多的小鼠和时间,工作量很大。另外,比例杀菌法不能检测抑菌或细菌生长停顿,因此,在药物的初筛中,不宜做为常规使用。
(三)评价药物在临床治疗试验中的抗菌活性
(1)反复检测MI能定性地证明药物是否有效,但不能敏感地区别药物活性的强弱;BI的检查也是不够精确的评价方法。1968年,Shepard等报告了应用鼠足垫技术来检测瘤型麻风病人在有效的氨苯砜治疗期间氨苯砜对ML的杀菌率,首次为评价各个药物的抗菌活性提供了一个定性和敏感的方法,能精确判断至少99%有活力菌的杀灭情况以及杀菌速度。
实验方法:关于用药物治疗前和治疗期间的不同间隔时间。定期取活检标本或皮损切刮液(固定取材部位),集菌并制成接种菌悬液作鼠足垫接种(5×103~1.0×104/足垫)。治疗前即服当天的取材接种作为实验对照。治疗后取材的间隔时间应根据药物在动力法中所见抗菌活性差异而定,如用利福平治疗的病人,第2次取材可安排在患者疗后2~3天,但对氨苯砜治疗的病人,取材时间宜在疗后4、8和12周。
根据Shepard技术,在接种ML3个月开始,每月处死一只小鼠,将接种的后足垫取下作固定和脱钙处理,其方法如下:将足垫放入10%中性福尔马林溶液中,置室温4天。第5天将足垫移到脱钙液中(脱钙液配制:70%酒精3800毫升加入甲酸200毫升即为5%甲酸酒精液。酒精预先在37℃孵箱中预热过夜,临用时加入甲酸)。每只足垫约用脱钙液30~50毫升,放于37℃,每天换脱钙液共5天。第6~15天为振荡脱钙,脱钙液需每天更换。随后将足垫制成组织病理切片作抗酸染色。当切片出现明显损害时,即在540倍显微镜视野内损害至少占 ,并充满抗酸菌,伴有或不伴有典型浸润,这表明“潜伏期”结束,此时即可开始进行足垫菌计数检查,一般是制成4个足垫的混合匀浆。通过对接种足垫菌计数,可计算出ML生长的世代时间。
,并充满抗酸菌,伴有或不伴有典型浸润,这表明“潜伏期”结束,此时即可开始进行足垫菌计数检查,一般是制成4个足垫的混合匀浆。通过对接种足垫菌计数,可计算出ML生长的世代时间。
在治疗过程中定期取活标本进行鼠足垫接种的实验结果表明,若潜伏期和世代时间的值不断增加,就表明有活力的ML逐渐减少,甚至已不能在小鼠中增殖。若潜伏期>12个月或世代时间≥100天,则表明接种物中ML已完全丧失了生活力。
应用上述的鼠足垫接种方法,能够比较几种治疗方案的效果或者某种药物的杀菌活性和杀菌速度。
Shepard等认为,鉴于鼠足垫试验对测定ML生活力有很高的敏感性和特异性,因此,在短程的临床治疗试验中,用少量病人即可初步测出药物在病人体内对菌的反应,作出对该药物效果的判断。若未见菌出现增殖,则应至少观察一年以上。表4-4是应用鼠足垫试验在少量病人(6~20例)中进行两组治疗方案效果比较的实例。用Fisher氏精确卡方检验出P值。
表4-4. 用四格表作Fisher氏精确卡方检验后求出相应的P值※

续表4-4
※ 单侧检验法:P值均<0.05
引自Shepard C.C.Lepr Rev 52(1)∶299,1981

(四)鉴定麻风杆菌的耐药菌株
麻风病在治疗中出现的耐药性问题,早被麻风工作者所注意。1953年Wolcott和Rees以及1963年第8届国际麻风会议上就有人提出了麻风病人出现耐药的观点。但是,由于缺乏实验室的依据而未被普遍接受,成为一个有争论的问题。直到1964年Pettit等才用鼠足垫感染模型证实了瘤型麻风病人对氨苯砜的耐药性,此后在其他一些国家陆续也有类似报告。1977年Pearson等首次报告了原发性耐氨苯砜病例。迄今,已经证明继发性和原发性氨苯砜耐药麻风在世界范围广泛分布,且已发现耐利福平,耐氯苯吩嗪和耐乙硫异菸胺病例。许多国家证实,用小鼠足垫感染模型确定耐药的实验室诊断方法是可靠而稳定的,与临床诊断基本一致。虽然可以通过治疗试验能证实耐药,但是用这类试验来证实低度耐药可能需要5年以上的时间,这会耽误病人有效的治疗。近年报告的几种体外试验检查出ML耐药菌株的快速方法,仍需进一步研究和证实。因此,鼠足垫技术仍是鉴定ML对药物敏感性的标准方法。
1、实验方法 用皮肤切刮法或活检法在BI和MI高的皮损部位取材,制成ML悬液,计算每毫升含菌量,取生理盐水或Hanks缓冲盐水稀释成每0.03毫升中含菌5.0×103~1.0×104条菌。每只小鼠单侧或双侧足垫皮下接种(0.03毫升/足垫)。
采用连续法给小鼠服药。将小鼠分成几组,每组5~10只小鼠,其中一组为不给药对照组,其它为不同剂量治疗组。以氨苯砜为例,小鼠分为对照组及0.01%、0.001%和0.0001%氨苯砜治疗组。氨苯砜、氯苯吩嗪、利福平和丙硫异菸胺均可采用药物饲料喂食或通过灌饲,因为这些药物自小鼠肠胃道吸收良好。由于将药物混合到饲料中喂食非常方便,因此很易被研究者接受。
小鼠接种ML后5~6个月,开始取2~4只小鼠的接种足垫进行菌计数检查,每隔2个月重复一次,直至每只足垫的平均菌数至少达5×105,此时立即对每个治疗组的至少4只小鼠的接种足垫进行菌计数检查。12个月后,如果发现对照组小鼠足垫中ML有增殖,但每只足垫中的平均菌数低于5×105时,也应对每个治疗组小鼠足垫作菌计数.菌数≥105条菌,则定为增殖。
2、结果判断
(1)敏感:ML增殖仅见于未治疗小鼠,而治疗组小鼠中未见菌增殖。
(2)耐药:至少一只治疗过的小鼠足垫中ML中出现增殖。耐药程度根据含有可使ML达到增殖标准的最大药物浓度的饲料来确定。对氨苯砜来说,耐药程度分为低度、中度和高度,根据ML分别在喂食每100克饲料中含0.0001、0.001或0.01克氨苯砜饲料的小鼠足垫中增殖能力而判断。
(3)不能确定:在药物治疗小鼠中未见菌增殖而在对照组小鼠中见鼠足出现增殖的小鼠很少,精确概率计算表明,不能区别有菌增殖的对照组小鼠数与零是否有差异。此种情况应将菌株在新的小鼠中进行传代,并作重复试验。
表4-5为6株ML作氨苯砜敏感试验的结果。
表4-5 6株麻风菌的DDS敏感试验※

※ Ji BH.:Int J lepr,1987,55(4)∶830
3、注意事项
(1)药物必须完全溶解,并尽可能均匀地与饲料混合。
(2)将一系列不同浓度含药饲料进行搅拌时,应先从药物浓度最低的饲料开始,再按顺序制备较大浓度药物饲料,这样可以不必因清洗搅拌器而停止工作,也不用担心低浓度药物饲料会被高浓度药物饲料所沾染。
(3)临床试验证实对氨苯砜治疗仍敏感的病例,而鼠足垫试验有可能呈现耐药,这是由于低度或中度耐药病例,对足量氨苯砜规则治疗会产生疗效。因此,在不能进行鼠足垫试验的情况下,对临床治疗试验有效者,不要轻易除外耐药的可能性,要结合病史、症状和细菌的动态变化来进行更长时间的观察。此外,在临床怀疑耐药的病例中,有一部分患者实际上是未进行标准治疗或由于对药物吸收不良、排泄快、代谢缺陷和其它原因所致。
据研究,ML对药物的敏感性和耐药性能够遗传,耐氨苯砜ML菌株能在未治疗的小鼠中传许多代。另外,氨苯砜以外的其它抗麻风药物的临界浓度尚未象氨苯砜那样完全确定,仍需进一步研究和证实。
(五)持久菌
持久菌是指在杀菌药物保持有效浓度的条件下仍能存活并对抗麻风药物敏感的菌。有人认为,持久菌所以能避开杀菌药物的作用,可能是由于菌的代谢变慢或处于休眠状态的缘故。1974年Water等报告,12例瘤型病人作氨苯砜治疗10~12.5年后,其中7例病人的皮肤、肌肉及周围神经内,尚能检出少量活菌,而且对氨苯砜敏感。新近,世界卫生组织麻风化疗临床试验小组委员会社会工作组在巴马科和钦格尔普特的研究表明,瘤型麻风用利福平、氨苯砜和氯苯吩嗪或丙硫异菸胺治疗2年,仍能在少数病人的标本中发现持久菌。468份皮损活检标本的ML经用T/R小鼠接种,结果证实,有43份标本带有麻风持久菌,阳性率为9.2%。试验结果也表明,持久菌的检出与接种菌量治疗方案(5种方案比较)、治疗时间以及病人年龄、病型等特点都无关,但同检查频率有关。
出现持久菌是麻风治疗中的难题,也是构成麻风复发的重要因素,值得深入进行研究,这对控制和消灭麻风病具有重要意义。
持久菌检出方法:将麻风病人的皮损活检标本制成接种菌悬液,经精确计算菌量后接种免疫抑制的裸鼠、T/R小鼠、NTLR大鼠等。因为具有免疫缺损的动物对ML高度易感,并能进行高菌量接种(105~108),从而提高了在大量死菌中发现少量残存活菌的机会。ML接种动物一年之后,逐个检查动物接种部位的菌量,如果发现ML增殖,则需进一步作传代试验以证实菌是否具有活力,或用比例杀菌法测定最大可能活菌数(MPN)。
三、麻风传播途径的研究
麻风动物模型为研究麻风病的传染途径提供了有效方法。鉴于麻风病患者鼻腔排菌的特殊性,Rees曾用免疫抑制的T/R小鼠进行了ML经呼吸道感染的研究。实验是使T/R小鼠吸入含ML1.0×105条的气溶胶,结果发现ML能达到小鼠肺部,并能播散到耳、足垫和鼻等部位,证明了ML经呼吸道途径传播的可能性。近年来,有人报道选用免疫缺陷动物--裸鼠作了类似的麻风传播途径的研究,他们采用烟雾法、灌饲法、喂食法以及气管切开法等,使ML直接与动物接触,然后定期解剖动物作菌计数及组织病理学观察,企图确定ML的入侵门户及其在麻风传播中的作用,这些研究对麻风的流行病学意义是很重要的。
免疫正常小鼠和免疫缺陷的裸鼠、T/R小鼠、NTLR以及犰狳麻风动物模型在麻风病防治研究中起到了多方面的、不可忽视的重要作用,尤其在ML至今不能进行体外人工培养的情况下更是如此。目前,灵长类动物如黑猩猩、黑长尾猴、恒河猴等的ML感染研究也有不少新的有意义的进展,但是由于这些动物来源少、饲料条件和管理要求都很高,应用这些动物进行麻风病的研究工作尚有很大困难,因此就不再予以介绍。