消化腺
出处:按学科分类—医药、卫生 中山大学出版社《临床人体解剖生理学》第418页(10176字)
人体消化腺按其体积的大小和位置的不同,可分为大消化腺和小消化腺两种。大消化腺位于消化管壁外,是独立的消化器官,消化液经过专门的导管流入消化管内,如肝、胰和三对唾液腺。小的消化腺主要分布于消化管壁的黏膜或黏膜下层内,如胃腺和肠腺等。消化腺分泌的消化液含有分解食物的各种酶。
(一)肝
1.肝及肝外胆道肝(1iver)是人体最大、血管极其丰富的腺体,红褐色,质软而脆,具有分泌胆汁、参与代谢、贮存糖原、解毒及吞噬、防御等功能,在胚胎时期还有造血功能。中国成人肝重约为1250g(男性为1154~1447g,女性为1029~1379g)。肝呈不规则的楔形,大部分位于右季肋区和上腹区,小部分位于左季肋区,可分膈(上)面、脏(下)面和前、后以及不明显的左、右四缘(图9-37A~H)。

图9-37 肝的外形分部(A~C)

图9-37 肝的外形分部(D、E)

图9-37 肝的外形分部(F、G)

图9-37 肝的外形分部(H)
膈面(diaphragmatic surface)即肝的上面与膈相接触,故名;由镰状韧带(falciform ligament)分为大而厚的右叶和小而薄的左叶。膈面的后部没有腹膜被覆的部分称为裸区(bare area),裸区的左侧有一较宽的沟称腔静脉沟(sulcus for vena cava),有下腔静脉通过。
脏面(visceral surface)位于肝的下面,凹凸不平,与腹腔器官邻接。脏面有一近似“H”形的沟,即有二条矢状位的纵沟和一条横沟。左纵沟的前部有肝圆韧带(1igamentum teres hepatis),是胎儿时期脐静脉(umbilical vein)闭锁而成,向前进入镰状韧带,连于脐;左纵沟的后部有静脉韧带(venous ligament),是胎儿时期静脉导管(venous duct)的遗迹。右纵沟的前部有一凹窝,称胆囊窝(fossa for gallbladder),容纳胆囊(gallbladder);右纵沟的后部有腔静脉沟(sulcus for vena cava),有下腔静脉(inferior vena cava)经过。横沟称为肝门(porta hepatis)(图9-37B、C、E),是肝固有动脉(proper hepatic artery)、肝门静脉(hepatic portal vein)、肝管(hepatic duct)、神经淋巴管等出入之处;这些结构由疏松的结缔组织围绕,称为肝蒂(hepatic pedicle)。。肝的脏面借H形沟分为四叶,右纵沟右侧为右叶(right lobe of liver),左纵沟左侧为左叶(1eft lobe of liver),左、右纵沟之间在横沟前方为方叶(quadrate lobe),横沟后方为尾状叶(caudate lobe)(图9-37B、C)。
肝的前缘也称下缘,锐利,为膈面与脏面的分界线。后缘钝圆,朝向脊柱,在近腔静脉窝处有2~3条肝静脉(hepatic veins)注入下腔静脉,临床上常把肝静脉注入下腔静脉静脉之开口称为第二肝门。
胆囊(gallbladder)位于肝右叶下面的胆囊窝内,借结缔组织与肝相连,下面游离有腹膜覆盖,胆囊可分为四部分:前端圆钝略膨大称胆囊底(fundus of gallbladder),多露于肝的前下缘,并与腹前壁内面相接触,其体表投影点在右锁骨中线与右肋弓相交处。当胆囊病变时,此处常出现明显压痛点,称Murphy征。中间称胆囊体(body of gallbladder),它与底无明显界线。体向后逐渐变细为胆囊颈(neck of gallbladder)。胆囊颈细而弯曲,然后转向后下与胆囊管相接。胆囊管(cystic duct)长约0.62~4.23cm,直径约0.3cm,中国人内窥镜胆管造影直径平均0.28(0.1~0.7)cm。近胆囊颈的一段其黏膜形成螺旋状的皱襞,称螺旋襞(spiral fold),可控制胆汁的进出,胆囊结石易嵌顿于此。胆囊具有贮存、浓缩胆汁及调节胆道压力的作用,容量为40~60ml(图9-37A~C、图9-38)。

图9-38 胆囊及输胆管道(A、B(1)~(7))

图9-38 胆囊和输胆管道(B(8)~(16))
胆汁由肝细胞产生,经肝内各级胆管收集,出肝门后,先贮存于胆囊,并由胆囊浓缩,消化时再经肝外胆道输到十二指肠。肝外胆道包括肝左管(1eft hepatic duct)、肝右管(right hepatic duct)、肝总管(common hepatic duct)、胆囊管(cystic duct)、胆囊(gallbladder)与胆总管(common bile duct)(图9-38A、图9-39)。肝左管、肝右管分别来自肝的左叶和右叶近肝门处,肝总管是由肝左管与肝右管汇合而成。肝总管有极大的外科重要性,它是术后狭窄多见的解剖部位。肝左、右管之间的夹角通常在100°~120°之间,据临床报道肝左、右管与肝总管汇合之前成直角或呈“T”形的结合形式,已证实肝管内结石较难于排出,插管时也较困难。中国人资料显示肝右管与肝总管延长线夹角为46.00°±3.67°,肝左管为40.00°±2.34°。据临床100例内窥镜逆行造影资料显示,肝总管近端横径平均0.69(0.21~1.18)cm,远端横径平均0.75(0.3~1.2)cm。其下端与胆囊管合成胆总管。中国人胆总管长度:成人3.0~10.0cm,多见范围4.1~8.0cm;儿童1.1~6.0cm,多见范围2.1~4.0cm。中国人100例内窥镜逆行胆道造影资料显示,胆总管近端横径平均0.76(0.48~1.21)cm。胆总管起自肝总管与胆囊管的汇合点向下与胰管相汇合,在胰头与十二指肠降部之间最后斜穿十二指肠降部后壁内侧中与胰管汇合,形成略膨大的肝胰壶腹(hepatopancreatic ampulla,vater壶腹),壶腹开口于十二指肠大乳头。在肝胰壶腹周围有肝胰括约肌(sphincter of hepatopancreatic ampulla,即oddi括约肌)包绕。肝胰壶腹括约肌不进食时保持收缩状态,由肝分泌的胆汁,经肝左、右管、肝总管、胆囊管进入胆囊贮存;进食后,尤其进食高脂肪食物,除肝分泌的胆汁直接排入十二指肠外,胆囊收缩,肝胰壶腹括约肌舒张,胆囊内的胆汁经胆囊管、胆总管排入十二指肠。其中胆囊管的行程以及与肝总管的结合形式有各种变异,这些变异有临床参考意义。详见图9-38B。

图9-39 胆道的行程及毗邻关系
2.肝的组织结构 肝表面有致密结缔组织被膜(也称Glisson囊)。在肝门处,此结缔组织纤维囊特别发达,并包绕门静脉、肝动脉和肝管的分支形成Glisson鞘,进入肝内,成为Glisson系统,将肝实质分隔成许多肝小叶。肝小叶(hepatic lobule)是肝脏的结构和功能单位,呈多面形棱柱体,长约2mm,宽约1mm。其长轴中央有肝静脉的终末支中央静脉(central vein)穿过。成人肝脏约有50~100万个肝小叶。肝小叶主要结构为肝细胞和肝血窦。肝细胞以中央静脉为中心呈放射状排列,单排肝细胞组成立体板状结构,称肝板(hepatic plate)(图9-40),相邻肝板互相吻合成网状;肝血窦位于肝板之间,通过肝板上的孔洞互相通连;相邻肝细胞接触面,质膜内陷成沟,两沟对合成微细管道,称胆小管(bile canaliculi),以盲端起始于中央静脉附近,在肝板内互相连接成网。肝细胞分泌的胆汁经胆小管汇入肝小叶周边的小叶间胆管(interlobularbile ducts)。在肝组织切片中,肝板的断面呈索状,称肝索(hepatic cord)(图9-41)。

图9-40 肝小叶模式图
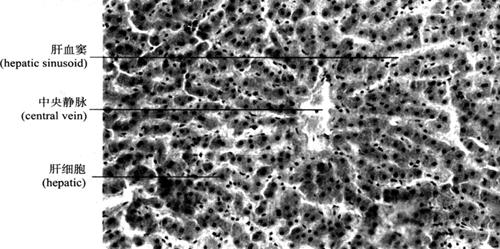
图9-41 肝脏(200×)
(1)肝细胞(hepatocyte):呈多面形,核大而圆,位于中央,异染色质少而分散,核仁清楚,表明细胞合成蛋白质的功能活跃。肝细胞内有各种细胞器及糖原、脂滴和色素等内含物(图9-42)。

图9-42 肝细胞超微结构模式图
a.线粒体(mitochondria):肝细胞线粒体遍布胞质,为细胞代谢活动提供能量。
b.粗面内质网(rough endoplasmic reticulum):呈层状排列成群,分布于核周,近血窦面及线粒体附近,是肝细胞合成蛋白质的基地。合成多种血浆蛋白,如白蛋白(albumin)、纤维蛋白原(fibrinogen)、凝血酶原(prothrombin)等。
c.滑面内质网(smooth endoplasmic reticulum):功能甚多,其膜上有多种规律分布的酶系,对多种有机物进行合成、分解、结合、转化等反应,参与胆汁合成、脂肪代谢、激素代谢、糖代谢、解毒作用等。从肠道吸收的众多有机异物(药物、腐败产物等)多为疏水性,在肝细胞滑面内质网进行氧化、还原、分解、结合等反应转化为水溶性,易于经血液由尿排出或经胆汁排出。
d.高尔基复合体(Golgi complex):由肝细胞内质网合成的蛋白质和脂蛋白经高尔基复合体的加工、浓缩和贮存,再经分泌小泡排入血窦。此外还参与胆汁的分泌。
e.溶酶体(1ysoseme):消化肝细胞吞饮的物质、退化的细胞器或细胞内过剩的物质。
f.微体(microbody):较发达,内含过氧化物酶、过氧化氢酶等,参与肝细胞内物质代谢和解毒作用。近年发现肝细胞微体与脂类代谢、嘌呤代谢和酒精代谢有密切关系。它可催化脂肪酸的β-氧化。如降血脂药,通过对肝细胞微体影响,使其数量增加,β-氧化作用提高8~18倍,同时过氧化氢酶活性增加,使血脂降低。
人摄取的酒精大部分经肝的基质内乙酰脱氢酶分解,约5%~25%的酒精受微体内酶的氧化作用,形成醛缩醇(acetal),故有清除酒精的作用。
g.内含物(inclusion):糖原在进食后增多,饥饿时减少;脂滴正常时较少,病变时增多。
肝细胞有三种功能面:血窦面、胆小管面、肝细胞连接面。血窦面和胆小管面有发达的微绒毛,使其表面积扩大数倍;细胞连接面形成紧密连接、桥粒等,环绕胆小管四周,封闭其使胆汁不致外溢。
(2)肝血窦(hepatic sinusoid):是位于肝板之间的窦状毛细血管,来自小叶间动、静脉终末支的血液经其汇入中央静脉。肝血窦壁由一层有孔内皮细胞组成,通透性较大,有利于肝细胞与血液间物质交换。窦内有许多形状不规则的巨噬细胞(macrophase),称枯否细胞(Kupffer cell)(图9-43),具有变形运动和吞噬功能,可清除血液内异物、细菌、衰老的红细胞。由于其数量大,分布在血窦内重要部位,构成机体重要防御屏障,尤其在抗肝癌作用方面受到重视。体外培养的Kupffer细胞受肿瘤抗原刺激后,体积增大,Fc受体增加,与肿瘤细胞贴附力增强,细胞分泌肿瘤坏死因子(TNF)增多,可杀伤和破坏肿瘤细胞,而不影响正常细胞。

图9-43 肝索与肝血窦(400×)
肝细胞和肝血窦内皮细胞之间的狭窄腔隙,称窦周隙(perosonusoidal space)或狄斯间隙(Disse space),充满血浆,肝细胞血窦面的微绒毛伸入其内,有利于物质充分交换。窦内常见一种形态不规则的贮脂细胞(fat-storing cell)和少量网状纤维,具有贮存脂肪和维生素A的作用。在慢性肝病和肝硬化时,贮脂细胞增多,可转化为合成胶原活跃的成纤维细胞,使肝发生纤维增生性病变。
(3)胆小管(bile canaliculi):是相邻肝细胞局部质膜凹陷形成的管道。以盲端起始于中央静脉附近的肝板内,向肝小叶周边伸展,胆小管周围的肝细胞膜形成连接复合体,当肝细胞坏死或胆管阻塞时,连接复合体破裂,胆汁溢入血液,出现黄疸。
(4)肝门管区:相邻肝小叶与肝小叶之间的结缔组织,见三种管道伴行,称门管区(portal area)(图9-44)。小叶间动脉是肝动脉的分支,管径细,腔小,管壁相对较厚;小叶间静脉是门静脉的分支,管径大,腔大而不规则,管壁薄;小叶间胆管是肝管的分支,管壁为单层立方上皮。

图9-44 肝门管区(400×)
(二)肝的形态和肝外胆道的异常
1.肝的形态异常
(1)副肝(accessory liver)是指同固有肝完全分离的肝组织片断或萎缩退化的肝组织.人体中并不多见。副肝多见于三角韧带、冠状韧带或镰状韧带内,也可见于大网膜、腹膜、胆囊壁或其他部位(图9-45A)。

图9-45 肝形态异常示意图
(2)副肝叶(accessory liver lobe)在肝形态异常中较常见,常在手术或尸体解剖中见到,其中Riedel叶是副肝叶中最多见的一种(图9-45B)。Riedel叶位于胆囊窝的右侧,是肝右叶呈舌状向下延伸,与肝右叶分界明显,有时可从肝右叶脱离,也可见小至为一块肝组织块,或大如球状,或借一条纤维的肝组织蒂与肝相连,它的出现率男2.1%,女4.5%。Riedel叶可以是先天存在,或胆结石、胆囊炎粘连牵拉等而形成。在临床上由于Riedel叶的存在,犹如一位于腹部右侧或右髂窝的肿物,可随呼吸而升降,有可能被误诊为右髂窝肿物或肾下垂。
(3)异位肝(abnormalous of the liver)很少见,曾有膈上异位肝的报导(图9-45C)。可见于腹腔腹后壁或盆腔。
2.肝外胆道的异常
(1)副(胆)肝管(acessory hepatic(bile)duct)(图9-46A~C):是指在肝门区除左、右肝管外,从某叶肝实质中独立发出,并直接与肝胆道的某一段相汇合的肝管。但由于对副肝管有不同的理解,故在文献中的出现率变动较大,约5%~15%不等。一般有四种形式:①副肝管(acessory hepatic duct); ②肝管通于胆囊管(hepatic duct entering cystic duct)极少见;③胆囊肝管(cholecystohepatic duct)较少见;④胆下肝管(subvesieal duct)。

图9-46 各种类型的副肝管(A~C)
由于副肝管多见于右侧,偶见于左侧,多为一条也偶见两条,且绝大多数位于胆囊三角(cystic triangle)或肝胆囊三角即Calot三角内,故与胆囊管、胆囊动脉及肝右管局部关系密切,走向近似,因此在胆囊手术对辨认副肝管是否存在具有重要意义。若不慎误伤副肝管而又未及时作适当处理,有可能导致术后胆汁外漏,并发为胆汁性腹膜炎、胆外瘘。副肝管的各种类型见图9-46A~C。
(2)胆囊(gallbladder):胆囊的变异并不常见,但颇具临床的重要性,稍不慎有可能造成严重后果。先天性胆囊变异可见于:数目的变异、形态变形和位置异常(图9-47A~G)。
a.先天性无胆囊(congenital absence gallbladder)极为罕见,据统计,至20世纪70年代全世界文献报导不足200例,尸检中发生率为0.03%~0.05%。如果手术中在正常的解剖位置找不到胆囊,不能轻易地确定无胆囊,必须仔细进行寻找,并排除肝内胆囊或左侧胆囊后方可确认无胆囊。无胆囊可能有家族史。现在的超声检查完全有可能检出有无胆囊(图9-47A)。

图9-47 胆囊变异及先天性胆道闭锁、胆总管囊性扩张示意图(A、B)

图9-47 胆囊变异及先天性胆道闭锁、胆总管囊性扩张示意图(C~F)

图9-47 胆囊变异及先天性胆道闭锁、胆总管囊性扩张示意图(G)
b.双胆囊非常少见,约3000~4000人中见到一例。是指同时存在两个互不相连各自独立的胆囊管,它们可分别汇入胆总管、肝总管、肝右管、肝左管或肝实质。或两个胆囊底分开,颈部合为一,有正常胆囊管,形似“V”形;2个胆7囊,分开并各有一胆囊管,但与肝总管汇合为一,故整体胆囊呈“Y”形(图9-47B)。
c.胆囊形态异常表现为:双房性胆囊,外表正常,内面有一纵隔将胆囊腔分成两个小房;双叶性胆囊,胆囊明显分为两叶,囊颈连合;胆囊憩室,及沙漏或葫芦状胆囊(图9-47C~E)。
d.异位胆囊有:左位胆囊、横位胆囊、肝左叶后或右叶后位胆囊、肝内胆囊及游离或系膜样胆囊(图9-47F)。
e.胆囊管与肝总管结合形式:胆囊管通常在肝总管的右侧,以锐角(约45。)汇合成胆总管。在实际观察中,有报道以锐角汇合的仅占20%,较多的是以其他形式相汇合。由于胆囊管与肝总管汇合形式在腹腔镜胆囊、胆管手术中的重要性,如出现胆囊管汇入肝总管的前壁、后壁或跨越肝总管汇入左前壁等等,这些多变的汇合情况都有可能限制腹腔镜的应用。各种汇合形式见图9-38B。
f.先天性胆管闭锁(congenital billary atresia)是胆管最严重的畸形。可以是某管的一段或整个管,甚至或整个肝外胆道闭锁,故有多种形式(图9-47G)。
(三)胰
1.胰腺的形态和位置(图9-20、图9-39) 胰(pancreas)是一个狭长形的腺体,全长约4~20cm,胰体略呈三角形,质地柔软,重约80.48~116.58g,在第1~2腰椎水平横贴于腹后壁,可分为头、体、尾三部分。胰头(head of pancreas)较大,位于第2腰椎右侧,被十二指肠所围绕,并向左下方伸出一钩突(uncinate process),胰头后面与胆总管、门静脉相邻。胰体(body of pancreas)为胰的中间大部分,位于第1腰椎平面,前面隔网膜囊与胃后壁相邻,当胃后壁的癌肿或溃疡穿孔常与胰粘连;后面与下腔静脉、腹主动脉、左肾和左肾上腺相邻。上缘有脾血管通过。胰尾(tail of pancreas)较细,向左上方抵达脾门。在胰实质内,与胰的长轴一致的排泄管,称胰管(pancreatic duct),它与胆总管汇合后,共同开口于十二指肠大乳头(maior duodenum papillae)。有时在胰头上部常有一小管位于胰管上方,称副胰管(accessory pancreatic),开口于十二指肠小乳头(minor duodenun papillae)。
2.胰腺的组织结构胰腺(pancrease)表面有薄层结缔组织被膜。实质由外分泌部和内分泌部组成(图9-48)。

图9-48 胰腺(400×)
(1)外分泌部:占胰腺实质的大部分,为复管泡状腺,由腺泡和导管组成。腺泡属纯浆液性,由一层锥体形的腺细胞组成,细胞顶部呈嗜酸性,含大量酶原颗粒,基底部含丰富粗面内质网,故呈碱性。腺泡腔内常见扁平而染色浅的泡心细胞(centroacinar cell)(图9-48、图9-49),是伸入腺泡腔内的闰管上皮细胞。与腺泡相连的细长导管称闰管(intercalated duct),直接与小叶内导管相连,无分泌管,小叶内导管汇入小叶间导管,再汇合到胰主导管(main pancreatic duct)。导管上皮由单层扁平上皮移行为单层柱状上皮,胰主导管管壁较厚,为单层高柱状上皮,从胰尾至胰头行经胰腺全长,大部分主导管先与胆总管汇合后再通入十二指肠,故胆道疾病有可能诱发胰腺病变。外分泌部分泌含胰蛋白酶、胰脂肪酶、胰淀粉酶等多种消化酶的胰液,消化食物。
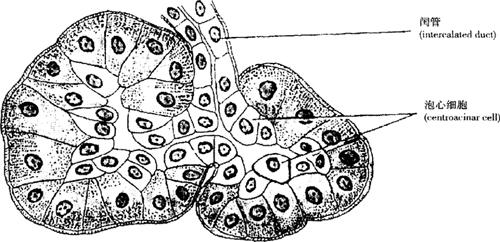
图9-49 胰腺腺泡泡心细胞模式图
(2)内分泌部:称胰岛(pancreatic island),是散在外分泌部之间的内分泌细胞团。成人胰岛约100万个,胰岛大小不等,含丰富的毛细血管。多见于胰尾部,在HE染色切片中胰岛细胞着色浅,难以分类,用Mallory-azan染色法可分为A、B、D三种细胞。
a.A细胞:约占20%,胞体较大,呈三角形或卵圆形,多分布在胰岛周边部。Mallory-azan染色:呈鲜红色。电镜下,胞质内含大小中等的分泌颗粒。A细胞分泌高血糖素(glucagon),可促进糖原分解,使血糖升高。
b.B细胞:为胰岛的主要细胞,占75%,主要位于胰岛中央部。细胞较小,分界不明显,核圆居中,Mallory-azan染色:呈桔红色。电镜下,胞质含大小不等的分泌颗粒。B细胞分泌胰岛素(insulin),可促进糖原合成和葡萄糖的利用,使血糖含量减少。它与高血糖素共同调节和维持血糖的稳定。胰岛素缺乏时,糖的正常代谢受阻,血糖升高,并从尿排出,称糖尿病(diabetes)。
c.D细胞:占5%,散在于A、B细胞之间,Mallory-azan染色:呈蓝色。电镜下,胞质内分泌颗粒较大。D细胞分泌生长抑素(somatostatin),可调节A、B细胞的功能活动。对胰岛素、高血糖素和胰多肽的释放起抑制作用。
近年来还发现人和某些动物的胰岛内有PP细胞和D1细胞。PP细胞体积小,分泌胰多肽(pancreatic polypeptide),有抑制胃肠运动、减弱胆囊收缩等功能。D1细胞的形态不规则,可分泌血管活性肠肽(VIP),可引起胰腺腺泡分泌和抑制胃酶分泌等。
(胰岛内分泌功能见第15章“内分泌系统”。)