水质分析
出处:按学科分类—农业科学 农业出版社《水产养殖手册》第42页(25952字)
一、海水盐度(S‰)的测定
(一)方法 折射率测定法
(二)仪器 光学折射盐度计(syy1-1型)
(三)测定步骤 参照仪器使用说明书
(四)说明
1.仪器的测量精度为±0.3(‰)。如需对仪器进行定标校正时,可使用标准海水(温度在20℃或低于20℃时可使用蒸馏水)。定标校正时,必须使仪器、标准海水(或蒸馏水)的温度保持一致。
2.测定完毕后,需用洁净淡水冲洗两遍,将水吸干,用擦镜纸擦净,以免海水对仪器的腐蚀。
二、电导率的测定
(一)仪器 水质分析仪(CS-1型)
(二)测定步骤 参照仪器使用说明书
(三)说明
1.该仪器已设计了自动温度补偿装置,电导率已换算为20℃的标准值,不必再考虑温度对电导率的影响。
2.欲对仪器进行校正,以保证其准确度时,可以下列标准溶液的电导率作为参考。
氯化钾标准溶液的电导率(25℃)是:
0.0001M(1)时为14.94μs/cm;
0.0005M时为73.90μs/cm;
0.001M时为147.0μs/cm;
0.005M时为717.8μs/cm。
3.在任意温度下所测得的电导率(Kt),可按下式换算为某标准温度(如20℃)时的电导率(K)值。
Kt=K〔1+α(t-20)〕
式中:α系各离子电导率的平均温度系数,定为0.022是比较合适的。
三、溶解氧的测定
(一)温克勒(Winkler)法 此法适用于洁净的淡、海水。
1.仪器与器皿 碱式滴定管,25ml。移液管,20ml。吸量管,2ml。碘量瓶,250ml。三角烧瓶,250ml。水样瓶,125ml(细口瓶)。量筒,100ml。容量瓶,1000ml。
2.试剂及其配制
硫酸锰溶液:称取硫酸锰(MnSO4·4H2O)(三级)240g(或MnSO4·H2O200g),配制成500ml溶液。
碱性碘化钾溶液:称取氢氧化钠(三级)250g,在搅拌下溶于250ml蒸馏水,冷却后,加碘化钾(三级)75g,搅拌溶解,稀释至500ml。
1∶1硫酸:将50ml浓硫酸小心地加到同体积蒸馏水中,混匀,盛于试剂瓶中。
4N(2)硫酸:将50ml浓硫酸小心地加到400ml蒸馏水中,混匀,盛于试剂瓶中。
0.01N硫代硫酸钠溶液:称取硫代硫酸钠(Na2S2O3·5H2O)(三级)2.5g,用煮沸而冷却的蒸馏水配制成1000ml溶液。
0.5%淀粉溶液:称取淀粉0.5g,配制成100ml溶液,搅匀,煮沸并至透明。
重铬酸钾标准溶液:称取重铬酸钾(一级,经烘干预处理)0.4903g,配制成1000ml,其浓度为0.01000N。
碘化钾(三级)
3.测定步骤
(1)取样:将与采水器连接的乳胶管的另一端接上玻璃管,放出少量水样,洗淌水样瓶两次。再将玻璃管插到水样瓶底部(不要与瓶底接触),开始慢慢注入水样(避免产生气泡),然后稍加快,待水样溢出约有瓶子体积的一半时,将玻璃管慢慢抽出,并关闭止水夹,塞紧瓶塞。
(2)固定:取样后立即进行固定。打开水样瓶瓶塞,立即以吸量管先移入1mlMnSO4溶液,再移入碱性碘化钾溶液1ml(吸量管尖接近水样,但不要接触水样)。塞紧瓶塞(瓶内不准有气泡),按住瓶盖将瓶上下颠倒不少于20次,静置。
(3)酸化:待沉淀降至瓶高的一半时,打开瓶塞,倒出少量清液(防止沉淀翻起)于三角烧瓶中,立即用吸量管加入1∶1H2SO41ml。塞紧瓶塞,反复摇晃水样瓶,直至沉淀全部溶解为止(若有沉淀仍未溶解,可再加少量H2SO4,至全部溶解)。
(4)滴定:将瓶内溶液沿瓶壁倒入三角烧瓶中,用0.01NNa2S2O3溶液进行滴定。当溶液呈淡黄色(稻草黄色)时,加1ml0.5%淀粉溶液,继续滴至无色。倒出部分上述测试液于原水样瓶内淌洗,再倒回原三角烧瓶中(此时试液应呈蓝色),继续滴至无色,待30s,如试液不再呈淡蓝色,即为终点。
(5)标定:移取20.00ml重铬酸钾标准溶液,沿壁移入碘量瓶中,用少量蒸馏水冲洗瓶壁,加0.4gKI,用吸量管移入2ml4NH2SO4,轻荡摇匀,塞好瓶塞,放置暗处5min。打开瓶塞,倒入50ml蒸馏水,摇匀,用0.01NNa2S2O3溶液滴定至淡黄色,加1ml0.5%淀粉溶液,继续滴至溶液呈淡绿色。
根据公式:N1V1=N2V2计算Na2S2O3溶液的当量浓度。
4.结果计算
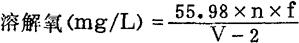
式中:n——滴定水样时用去Na2S2O3溶液毫升数;
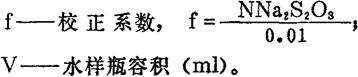

式中: N——Na2S2O3溶液的当量浓度;
V——滴定水样时用去Na2S2O3溶液的毫升数;
V样——水样瓶的容积(ml)。
(二)隔膜电极法
1.仪器 水质分析仪(CS-1型)。
2.测定步骤 参照仪器使用说明书。
3.注意事项
(1)用于测定海水或半咸水时,结果偏高,需作盐度校正。溶解氧含量(mg/L)=校正系数×指针指示值
表2-25 不同盐度的校正系数(近似值)

(2)由于电极的老化,仪器使用一段时间后,其准确度将受到一定的影响。因此,为了保证其准确度,可用温克勒法进行校正。
四、总硬度的测定
(一)方法 络合滴定法。
(二)仪器与器皿 酸式滴定管,25ml。移液管,50ml。吸量管,1ml。三角烧瓶,250ml。容量瓶,1000ml。
(三)试剂及其配制
氨缓冲溶液:称取2.358gEDTA二钠晶体(Na2H2Y·2H2O)及1.560gMgSO4·7H2O(或1.288gMgCl2·6H2O)溶于100ml纯水中,往其中加入NH4Cl33.8g,浓氨水286ml,混匀并溶解,用纯水稀释至500ml。贮存于聚乙烯瓶中,并将瓶塞盖紧。
0.02000NEDTA二钠标准溶液:称量前在80℃烘箱内烘2h。冷却。精确称取基准级EDTA二钠晶体(Na2H2Y·2H2O)3.7226g,溶解,转入1000ml容量瓶中,稀释至刻度,摇匀。
铬黑T指示剂:称取0.5g铬黑T同100g固体氯化钠共同研磨均匀。保存于棕色瓶中。
(四)测定步骤 移取50.00ml澄清水样,于三角烧瓶中,加氨缓冲液1ml和铬黑T指示剂少许(使溶液呈淡红色即可),在充分摇动的情况下,用EDTA二钠标准溶液进行滴定,滴到溶液由红色经紫色而变为纯蓝色,即为终点。临近等当点时,滴加速度要慢,每加一滴,要摇动几秒钟。到出现紫色后,每次以滴加半滴为宜,直到洽变纯蓝色为止。
(五)结果计算

式中: N、V——分别为EDTA二钠标准溶液的浓度及滴定水样
消耗体积(ml);
V样——水样体积(ml)。
(六)注意事项
1.如水样温度过低,应加热到30-40℃。
2.烘干EDTA二钠盐的温度应在80℃,不宜过高,否则会使结晶水受到损失。
五、pH值的测定
(一)方法 电位法。
(二)仪器 精度为0.02个pH单位的pH计。
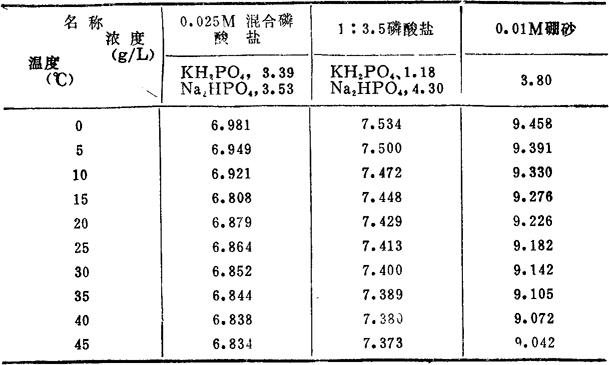
(三)标准缓冲溶液的配制 0.025M混合磷酸盐缓冲溶液(25℃时,pH=6.864):称取3.39g磷酸二氢钾和3.53g磷酸氢二钠(在115℃±5℃烘干2-3h),配制成1000ml溶液。保存于聚乙烯瓶中。
1∶3.5磷酸盐缓冲溶液(25℃时,pH=7.413):称取1.18g磷酸二氢钾和4.30g磷酸氢二钠(在115℃±5℃烘干2-3h),配制成1000ml溶液。保存于聚乙烯瓶中。
0.01M硼砂缓冲溶液(25℃时,pH=9.182):称取1.90g硼砂(在盛有蔗糖饱和溶液干燥器中平衡两昼夜),溶于刚煮沸冷却的蒸馏水中,配制成500ml溶液。分装于5个100ml聚乙烯瓶中,瓶口用石蜡封住。
各种标准缓冲溶液的pH值随温度的改变而变化。0-45℃间的pH值,列于表2-26。
表2-28 标准缓冲溶液的pH值随温度的变化表
(四)测定步骤 参照仪器使用说明书。
(五)注意事项
1.玻璃电极在使用前应在蒸馏水中浸泡1-2昼夜。若因钝化,响应不好时,可用6N盐酸或20%氟化铵溶液浸泡。如浸泡后仍无效,则应更换新玻璃电极。
2.如甘汞电极的氯化钾液柱中有气泡时,应排除,否则会导致断路或使测定不稳定。
3.若测定时水温与采水时现场水温相差在3℃以上,应进行温度校正。
六、总碱度的测定
(一)酸直接滴定法
1.仪器与器皿 酸式滴定管,25ml。吸量管,2ml。移液管,20ml,50ml。三角烧瓶,250ml。容量瓶,500ml,1000ml。烧杯,200ml。称量瓶,高型,2.5×4.0cm。
2.试剂及其配制
0.05%甲基橙:溶解0.050g固体甲基橙于100ml纯水中。
0.02N盐酸标准溶液:取1.8ml浓盐酸,用无二氧化碳纯水(3)稀释到1000ml。溶液的准确浓度需用碳酸钠标准溶液标定。
0.02000N碳酸钠标准溶液:准确称取0.5300g无水碳酸钠(基准试剂,180℃烘2h)于烧杯中,用无二氧化碳纯水溶解,转入500ml容量瓶中,再用无二氧化碳纯水稀释到刻度。
3.测定步骤
(1)标定0.02N HCl标准溶液:用移液管准确移取20.00ml碳酸钠标准溶液于三角烧瓶中,加无二氧化碳纯水30ml,加0.05%甲基橙溶液3滴,用待标定的盐酸溶液滴定,不断振荡,滴到溶液由黄色变橙色为止。按下式计算盐酸的准确浓度:

式中:N、V——分别为盐酸的当量浓度和标定时所耗的体积(ml)。
(2)测定水样:量取50ml水样于三角烧瓶中,加0.05%甲基橙溶液3滴,在不断振荡下,用盐酸溶液滴定至橙色不变为止。
4.结果计算
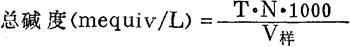
式中:T——滴定中所耗盐酸溶液的毫升数;
N——盐酸溶液的当量浓度;
V样——所取水样体积的毫升数。
(二)pH测定法 此法用于海水。
1.仪器与器皿pH计,精度为0.02个pH单位。具螺旋盖聚乙烯广口瓶,50mi。移液管,10ml,15ml。吸量管,5ml。容量瓶,1000ml。
2.试剂及其配制
0.006N盐酸标准溶液:移取8.4ml浓盐酸(比重为1.18)于1000ml容量瓶中,稀释至刻度,混匀。移取60ml上述盐酸溶液于另-1000ml容量瓶中,稀释至刻度,混匀,即为盐酸标准溶液。盐酸标准溶液的浓度,用碳酸钠标准溶液进行标定,以甲基红-次甲基蓝混合指示剂指示终点。所用溶液的配制方法如下:
0·0100N碳酸钠标准溶液:称取0.0530g无水碳酸钠(基准试剂,预先在220C下烘2h,置于干燥器中冷却)用少量蒸馏水溶解后,转入1000ml容量瓶中,稀释至刻度,混匀。
甲基红一次甲基蓝混合指示剂:称取32mg甲基红,用研钵研成粉末,溶于80ml乙醇(95%)中,依次加4.8ml0.1%次甲基乙醇溶液(0.1g/100ml)和1.18ml0.1N氢氧化钠溶液(0.4g/100ml),调匀,溶液呈暗绿色,盛于棕色试剂瓶中。
盐酸标准溶液浓度的标定:用移液管移取15.00ml碳酸钠标准溶液,加6滴指示剂,用盐酸标准溶液滴定。当溶液由橙黄色变为稳定的浅紫红色时即为终点。
0。05M邻苯二甲酸氢钾标准缓冲溶液:称取5.06g邻苯二甲酸氢钾(预先在115±5℃烘2-3h,于干燥器中冷却),溶于蒸馏水,转入500mi容量瓶中,稀释至刻度,混匀。保存于聚乙烯瓶中。
3.测定步骤 移取25ml水样于具螺旋盖聚乙烯广口瓶中,再移取10ml盐酸标准溶液于水样中,加盖旋紧,充分摇匀。参照仪器使用说明书,用0.05M邻苯二甲酸氢钾标准缓冲溶液,对pH计进行定位。用定位后的pH计测定摇匀后的混合溶液pH值。
4.结果计算
(1)绘制ALK-aH+工作曲线
根据实验条件下的Vs,Va,Na与fH+值,代入下式,得ALK-aH+的线性关系式。
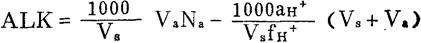
式中:Vs、Va——分别为水样和盐酸标准溶液的体积(毫升数);
Na——盐酸标准溶液的当量浓度;
aH+——混合溶液中氢离子活度(由测得的pH值换算而得);
fH+——混合溶液中氢离子活度系数。
例如:Vs=25.00ml,Va=10.00ml,Na=0.006000N,fH+=0.753(此值为氯度在12至18范围内的fH+平均值),代入上式得
ALK=2.40-1。86×103aH+
在厘米方格纸上,以aH+为纵坐标,ALK为横坐标,取aH+=0.500×10-8,则ALK′=1.47,在图上得一点A,另取a″H+=0.200×10-8,则ALK″=2.03,在图上得另一点B,连接A,B两点得一直线,即为ALK-aH+工作曲线。如图2-3。
表2-27 pH-aH+换算表

注表中v为pH值的小数部分,Q为pH的整数部分.由V值查表得相应的N值,代入下式
aH+=N×10-Q即得氢离子活度.
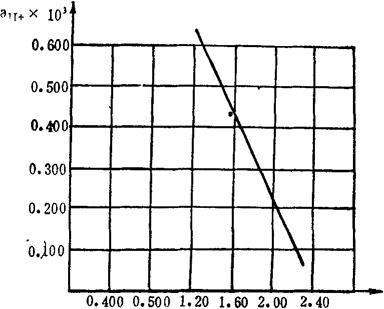
图2-3 ALK-aH+工作曲线图
绘制工作曲线时,要求三位有效数字。
(2)根据测得水样的pH值由表2-27查出相应的aH+值,再从ALK-aH+工作曲线,查出水样的ALK值。
5.注意事项 混合溶液的pH值为3.40-3.90,测定误差较小。如大于3.90时,应取出电极对,用移液管移取1ml盐酸标准溶液加入混合溶液中,混匀后重新测定pH值;如小于3.40时,则用移液管移取5ml水样于混合溶液中,混匀重新测定pH值。将所测得数据代入下式计算测定结果。
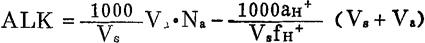
七、硝酸盐的测定
(一)酚二磺酸法 此法适用于淡水。
1.仪器与器皿 分光光度计,1台。蒸发皿,115ml。移液管,20ml。吸量管,5ml,10ml。容量瓶,50ml,200ml,1000ml。蒸馏瓶,500ml。烧瓶,250ml。
2.试剂及其配制
酚的制备:用热水浴将酚熔化,倒入蒸馏瓶中,插入250℃温度计一支,加热蒸馏,使用空气冷凝管收集182-184℃的蒸出液,所得即为无色纯净的结晶酚,应贮于棕色瓶中,密封保存。
酚二磺酸的制备:称取10g纯净的酚于250ml烧瓶中,加入比重为1.84浓硫酸125g,用橡皮塞子塞好,橡皮塞中插入一根顶端拉成毛细管的长玻璃管,防止加热回流时有水气进入。将烧瓶放入沸水浴中加热6-8h,得到浅棕色稠液即为酚二磺酸。转入棕色瓶中保存。
1∶1氨水:100ml市售浓氨水与100ml纯水混合均匀。
硝酸钾标准贮备溶液:称取0.7216g硝酸钾,溶于少量纯水中,转入1000ml容量瓶,稀释至刻度,混匀。浓度为0.100mg/ml(NO3-N)。
硝酸钾使用标准溶液:移取硝酸钾标准贮备溶液20.00ml于瓷蒸发皿内,在水浴上蒸干,加入1ml酚二磺酸,用玻璃棒摩擦蒸发皿壁,使酚二磺酸同全部干涸物接触,静置10min使作用完全。用纯水稀释并转入200ml容量瓶内,稀释至刻度,混匀。此溶液为淡黄色。其浓度为0.0100mg/ml(NO3-N)。
1N氢氧化钠:取20g氢氧化钠溶于纯水,稀释到500ml。
EDTA溶液:取25gEDTA二钠与10ml纯水调成糊状,加入30ml浓氨水,充分搅拌使其溶解。保存于聚乙烯瓶中。
3.测定步骤
(1)制定工作曲线:在6个50ml容量瓶中加入纯水40ml,1∶1氨水4ml,再分别移入硝酸钾使用标准溶液0,0.50,1.00,2.00,4.00,6.00ml,并用纯水稀释至刻度,混匀。待溶液颜色稳定后,在分光光度计上,用425nm波长,测定各容量瓶中溶液的吸光值A。在厘米方格纸上,以吸光值A为纵坐标,溶液中NO3-N的浓度为横坐标作图,即得工作曲线。
表2-28 硝酸盐工作曲线数据记录

(2)水样测定:取水样50ml于蒸发皿中,用1NNaOH溶液,小心地将水样调成弱碱性(用pH试纸试验),放在沸水浴上蒸发至干,冷却。冷却后,加1.0ml酚二磺酸,用玻璃棒摩擦蒸发皿内壁,使试剂同内壁干涸物全部接触,静置10min,使反应完全。
在蒸发皿内加纯水10ml,加1-3滴EDTA,搅匀。滴加1∶1氨水,直至颜色不再加深时为止,转入50ml容量瓶中,用纯水稀释至刻度,混匀。测定其吸光值(Aw)。
4.结果计算
An=Aw-At
式中:Aw——水样的吸光值;
An——水样中硝酸盐的吸光值;
At——水样浑浊吸光值。
由水样的An值查工作曲线,即得该水样中NO3-N的含量。
5.注意事项
(1)若水样有颜色,应用氢氧化铝悬浮液处理后,再进行测定(参照八、(一))。
(2)当水样中含Cl-在30mg/L以上时,应作除Cl-的处理,否则会使测定结果偏低。
(二)锌-镉还原法此法适用于海水。
1.仪器与器皿分光光度计,1台。电动振荡器,1台。广口试剂瓶,60ml,1000ml。三角烧瓶,100ml。吸量管,1ml,5ml,10ml。容量瓶,50ml,100ml,1000ml。滴瓶,60ml。烧杯200ml,50ml。
2.试剂及其配制
20%氯化镉溶液:称取20g氯化镉(CdCl2·2.5H2O),溶于纯水,稀释至100ml,盛于滴瓶中。
锌卷:将锌片裁成5×6cm的小片,用1.5cm外径的试管卷成5cm高的锌卷,置于具有瓶盖的1000ml广口瓶中。
硝酸钾标准贮备溶液:参照七、(一)酚二磺酸法中硝酸钾标准贮备溶液的配制。
硝酸钾使用标准溶液:移取5.0ml硝酸钾标准贮备溶液于100ml容量瓶中,稀释至刻度,混匀。此溶液1ml含NO3-N5μg。临用前配制。
磺胺溶液:称取5g磺胺(NH2SO2C6H4NH2),溶于350ml1∶6盐酸,稀释至500ml,盛于试剂瓶中。有效期为两个月。
盐酸萘乙二胺溶液:称取0.5g盐酸萘乙二胺(C10H7NHCH2-CH2NH2·2HCl),溶于500ml纯水,盛于棕色试剂瓶中。有效期为1个月。
人工海水:分别称取31g氯化钠、10g硫酸镁(MgSO4·7H2O)和0.05g碳酸氢钠(NaHCO3·H2O),溶于纯水,稀释至1000ml,盛于试剂瓶中。
3.测定步骤
(1)制定工作曲线:在6个50ml容量瓶中分别移入硝酸钾使用标准溶液0,0.20,0.40,0.60,0.80,1.00ml,用无氮海水或人工海水稀释至刻度,混匀。按序倒入6个洁净、干燥的60ml广口瓶中。每瓶用镊子放入1个锌卷,加2滴20%氯化镉溶液,按序将各广口瓶放入振荡器的带格的木盒中,进行振荡10min。迅速将广口瓶中的溶液按序倒入相应的6个100ml三角烧瓶中。
用吸量管各加入1ml磺胺溶液,混匀,放置5min。用吸量管各加入1ml盐酸萘乙二胺溶液,立即混匀,放置15min。
在分光光度计上,用540nm波长,测定各三角烧瓶中溶液的吸光值A。在厘米方格纸上,以吸光值A为纵坐标,溶液中NO3-N的浓度为横坐标作图,即得工作曲线。
表2-29 硝酸盐工作曲线数据记录

(2)水样测定:量取50ml水样,倒入60ml广口瓶中。每瓶放入锌卷1个,加2滴20%氯化镉溶液,用振荡器振荡10min。参照上述本法制定工作曲线中有关步骤,测定各水样的吸光值Aw。量取50ml水样,加1ml磺胺溶液,混匀,测定水样浑浊吸光值At。
4.结果计算
An=Aw-At-ANo2-N
式中:Aw——水样的吸光值;
An——水样中硝酸盐的吸光值;
At——水样浑浊吸光值;
ANo2-N——水样中原有亚硝酸盐的吸光值。
由水样吸光值An查工作曲线,即得该水样中NO3-N的含量。
5.注意事项
(1)水温在10-25℃时,温度对测定的结果影响不大。若温度大于25℃或小于10℃时,制定工作曲线时的温度和测定水样时的温度相差超过3℃,必须重新制定相应温度下的工作曲线。
(2)振荡后的水样,必须在8min内倒入三角烧瓶中,立即进行测定。若停留时间过长,对测定结果有一定影响。
八、亚硝酸盐的测定
(一)对氨基苯磺酸-α萘胺法 此法用于淡水,也可用于海水。但海水的盐度对吸光值有影响,故在配制标准系列时,需用人工海水代替蒸馏水进行稀释。
1.仪器与器皿 分光光度计1台。三角烧瓶,250ml1个。吸量管,2ml1支。容量瓶,50ml,100ml,500ml各1个。
2.试剂及其配制
对氨基苯磺酸:称取对氨基苯磺酸(NH2.C6H4·SO2H)2.0g,溶于400ml12%醋酸溶液中,混匀后贮存于棕色试剂瓶中。
α-萘胺:称取2.4g盐酸α-萘胺(C10H7NH2·HCl),加入40-60ml正在沸腾的纯水中搅拌,煮沸3-5min,使其充分溶解,用滤纸滤去未溶解的深紫色残渣。将滤液加入400ml12%醋酸溶液中,充分摇匀,贮备于棕色试剂瓶中。
亚硝酸试剂:取等体积的对氨基苯磺酸溶液与α-萘胺溶液混匀即成。此试剂不稳定,应在使用前1h配制。所配制的溶液应为无色,若呈红色,应弃去重配。
亚硝酸钠标准贮备溶液:准确称取经110℃烘干的亚硝酸钠(二级)0.2463g,溶于少量纯水,转入500ml容量瓶,用纯水稀释至刻度,加入0.5ml氯仿。此液1ml含0.1mg亚硝酸氮。
亚硝酸钠使用标准溶液:取1.00ml贮备液于100ml容量瓶中,用纯水稀释至刻度,摇匀。此液T=0.001mg/ml(NO2-N)。此液应当天配制。
氢氧化铝悬浮液:称取125g硫酸铝钾〔K2Al2(SO4)4·24H2O〕溶于1L纯水,加热至60℃后徐徐加入55ml浓氨水使成氢氧化铝沉淀,充分搅拌后静置,用倾泻法反复洗涤沉淀,至倾出液中无Cl-(用5%AgNO3溶液检查),最后加300ml纯水,使用前摇匀。
3.测定步骤
(1)水样预处理:如水样有色或浑浊,应先作预处理。即取200ml水样加2ml氢氧化铝悬浮液,反复振荡混合,静置数分钟后用中速滤纸过滤。最初滤出的50ml滤液弃去,收集以后的滤液作分析用。
(2)制定工作曲线:在6个50ml容量瓶中分别移入亚硝酸钠使用标准溶液0,0.25,0.50,1。00,1.50,2。00ml。用纯水稀释至刻度,混匀,按序倒入6个干燥的150ml具塞三角烧瓶内。
向上述各三角烧瓶内分别加入亚硝酸试剂2.00ml,混匀,放置30min后选择520nm波长测定吸光值。
在厘米方格纸上,以吸光值A为纵坐标,溶液中NO2-N的浓度为横坐标作图,即得工作曲线。
(3)水样测定:量取50ml水样于具塞三角烧瓶内,移入2ml亚硝酸试剂,混匀,放置30min后测定其吸光值Aw。
表2-30 亚硝酸钠工作曲线数据记录表

4.结果计算
An=Aw-At
式中:Aw——水样的吸光值;
An——水样中亚硝酸盐的吸光值;
At——水样浑浊的吸光值。
由水样的An值查工作曲线,即得该水样中NO2-N的含量。
5.注意事项
(1)滤纸中常含有亚硝酸根,水样经过滤后,结果往往偏高。故在使用前应先用纯水淋洗处理。
(2)此法显色速度较慢,20℃时需30min才稳定,低温时则更长。若水温过低应在水浴上加温至20℃左右(注意各份水样应受热一致,温度相同)。
(二)磺胺-盐酸萘乙二胺法 此法用于海水,也可用于淡水。
1.仪器与器皿 分光光度计,1台。吸量管,2ml。容量瓶,50ml,1000ml。三角烧瓶,100ml。
2.试剂及其配制
磺胺溶液:配制方法与硝酸盐测定中锌-镉还原法相同。
盐酸萘乙二胺溶液:配制方法与硝酸盐测定中锌-镉还原法相同。
亚硝酸钠标准贮备溶液与使用溶液的配制方法与对氨基苯磺酸-α萘胺法相同。
3.测定步骤
(1)制定工作曲线:在6个50ml容量瓶中分别移入亚硝酸钠使用标准溶液0,0.25,0.50,1.00,1.50,2.00ml,用纯水稀释至刻度,混匀,按序倒入6个干燥三角烧瓶内。
向上述各三角烧瓶内分别加入1ml磺胺溶液,混匀,放置5min。再加入1ml盐酸萘乙二胺溶液,立即混匀,放置15min。于540nm波长测定吸光值A。
(2)水样测定:量取50ml水样,加入1ml磺胺溶液,混匀,放置5min。再加入1ml盐酸萘乙二胺溶液,立即混匀,放置15min。于540nm波长测定其吸光值Aw。
4.结果计算 参照亚硝酸盐的测定(一),4。
5.注意事项 水样作浑浊测定时,一定要向水样中加入磺胺试剂(含酸)。因海水中的一部分浊度可能由钙质颗粒物质所产生,这些物质可被试剂中的酸所溶解,使实际浊度与加试剂的海水浊度不同。
九、总氮的测定
本测定采用过硫酸盐消解法。此法原理适用于淡水、海水和污水。下面介绍的内容是测定淡水中总氮的方法。
(一)仪器与器皿 紫外分光光度计,1台。100ml消解瓶或其他具塞容器。容量瓶,100ml,1000ml。吸量管,5ml。移液管,20ml,25ml,50ml。高压蒸气灭菌釜。
(二)试剂及其配制
蒸馏水:所用蒸馏水均经高锰酸钾重蒸馏处理。
碱性过硫酸钾溶液:将20g氢氧化钠溶于500ml水中,再加入15g过硫酸钾(K2S2O8)。要求此溶液含氮量不超过0.4mg/L。
0.75N盐酸:
氯仿:
氮标准贮备溶液:称取经105-110℃干燥4h后的硝酸钾(KNO3)0.7218g,用适量水溶解后,转移入1000ml容量瓶中,稀释至刻度,混匀。此溶液含氮量为0.1mg/ml。加入2ml氯仿,盛于棕色试剂瓶中,可保存6个月以上。
氮使用标准溶液:准确移取20.00ml氮标准贮备溶液,移入1000ml容量瓶中,稀释至刻度。此溶液含氮量为2.0μg/ml。
(三)测定步骤
1.水样的预处理 量取适量水样(总氮含量不超过0.1mg),放入消解瓶内,加水至50ml后立即密封。加入10ml碱性过硫酸钾溶液,再次密封进行混合。将消解瓶放入高压釜内,在120℃和1kgf/cm2压力下,加热消解30min,冷却后取出消解瓶,静置。
2.制定工作曲线 分别移取氮使用标准溶液0,0.50,1.00,1.50,2.50,5.00,25.00,50.00,75.0和100.0ml,于1000ml容量瓶内,加水至刻度,混匀。
分别移取上述各溶液50.00ml,装入消解瓶后密封。各瓶溶液含氮量分别为0,0.5,1.0,1.5,2·5,5.0,25,50,75,100μg。
加入10ml碱性过硫酸钾溶液,再次密封进行混合。
以下步骤按上述水样预处理中相应的步骤进行处理。
取出处理后样品的上部澄清液25。00ml,装入试管内,加入5.00ml0。75N盐酸使之呈酸性。用光程为1或5cm的石英吸收池,测定220nm波长下的吸光值。并作空白试验。
绘制含氮量(μg)和吸光值关系的工作曲线。
3.水样测定 取出处理后水样的上部澄清液25.00ml于试管内。以下步骤按制定工作曲线中相应的步骤进行操作。测定水样吸光值,从工作曲线上查得含氮量(μg)。
(四)结果计算

式中:A——从工作曲线查得的水样的含氮量(μg);
V——加入消解瓶中水样体积。
十、铵的测定
本测定采用次溴酸钠氧化法。此法没有盐的误差,适用于海水,也可用于淡水。
(一)仪器与器皿 分光光度计1台。具塞三角烧瓶,250ml。吸量管,1ml,2ml,5ml。容量瓶,50ml,1000ml。
(二)试剂及其配制
次溴酸钠氧化液:称取2.8g溴酸钾、20g溴化钾溶于1000ml无氨蒸馏水中,配制成0.1N溴酸钾-溴化钾溶液。使用时将此溶液稀释50倍,即为0.002N溴酸钾-溴化钾溶液。取50ml此种溶液于具塞试剂瓶中,加入3ml1∶1盐酸,迅速盖上塞子混匀,置于暗处5min,再加入50ml40%氢氧化钠溶液,即得次溴酸钠溶液(此溶液临用时现配)。
磺胺溶液:称取2g磺胺溶于1000ml1∶1盐酸溶液中。
盐酸萘乙二胺:称取0.5g盐酸萘乙二胺,溶于500ml蒸馏水中。
40%NaOH溶液:称取400g氢氧化钠(一级)溶于2000ml蒸馏水中,蒸发至原体积的一半。
氯化铵标准溶液:将氯化铵(二级)于100℃下烘干1h,冷却后称取3.820g,溶于少许无氨蒸馏水中,转入1000ml容量瓶,用无氨蒸馏水稀释至刻度,加入2ml氯仿以固定之。在测定前,再将此溶液稀释100倍,含氮量(NH4-N)为0.01mg/ml。以备使用。此溶液只能保存1-2天。
无氨蒸馏水:每升蒸馏水中加入2ml浓硫酸后进行蒸馏,弃去前面蒸馏出的约300ml,收集400ml蒸出液,贮存于聚乙烯瓶中。
(三)测定步骤
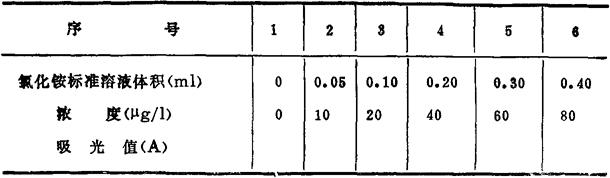
1.制定工作曲线 在6个50ml容量瓶中分别移入氯化铵使用标准溶液0,0.05,0.10,0.20,0.30,0.40ml,再用无氨蒸馏水或无氨海水稀释至刻度,混匀,按序倒入6个干燥的250ml具塞三角烧瓶内。
用吸量管移取5ml次溴酸钠溶液,分别加入具塞三角烧瓶中,混匀,放置30min。
用吸量管分别移入5ml磺胺溶液,混匀,放置5min。
用吸量管分别移入1ml盐酸萘乙二胺溶液,混匀,显色15min后在波长540nm条件下测定吸光值A。
在厘米方格纸上,以吸光值A为纵坐标,溶液中NH4-N浓度为横坐标作图,即得工作曲线。
2.水样测定 量取水样50ml,加入具塞三角烧瓶中。用吸量管移取5ml次溴酸钠溶液,于具塞三角烧瓶中,混匀,放置30min。
表2-31 铵盐工作曲线数据记录表
用吸量管移入5ml磺胺溶液,混匀,放置5min。
用吸量管移入1ml盐酸萘乙二胺溶液,混匀,显色15min后测定其吸光值Aw。
(四)结果计算
An=Aw-At-ANo2-N
式中:Aw——水样的吸光值;
An——水样中铵盐的吸光值;
At——水样浑浊吸光值;
ANo2-N——水样中原有亚硝酸盐的吸光值。
由水样的吸光值An查工作曲线,即得该水样中NH4-N的含量。
十一、化学耗氧量的测定
本测定采用高锰酸钾法。此法氧化条件有酸性与碱性两种。当水样中Cl-离子含量大于300mg/L时,则采用碱性条件;反之小于300mg/L时,可采用酸性条件。下面介绍的测定方法是碱性高锰酸钾法。
(一)仪器与器皿 碱式滴定管,25ml。移液管,10ml,20ml。吸量管,1ml,2ml,5ml。碘量瓶,250ml。三角烧瓶,250ml,容量瓶,1000ml。
(二)试剂及其配制
4N硫酸:配制方法同溶解氧的测定。
25%氢氧化钠溶液:称取25g氢氧化钠,溶于100ml蒸馏水中。
1∶3硫酸:在搅拌下,将1体积浓硫酸慢慢地倒入3体积蒸馏水中。
0.01N硫代硫酸钠溶液:配制方法同溶解氧测定。
0.01000N重铬酸钾标准溶液:配制方法同溶解氧的测定。
0.01N高锰酸钾溶液:称取3.2g高锰酸钾,溶于100ml蒸馏水中,加热煮沸10min,冷却后,移入棕色瓶中,稀释至10L,混匀。
0.5%淀粉溶液:配制方法同溶解氧的测定。
碘化钾(三级)。
(三)测定步骤
1.水样的测定 量取100ml水样于三角烧瓶中。用吸量管移入1ml25%氢氧化钠溶液,混匀。用移液管移入10ml0.01N高锰酸钾溶液,混匀。加温煮沸10min。冷却至室温,加0.5g碘化钾于三角烧瓶中,使其溶解,再加入1∶3硫酸5ml,混匀。
用0.01N硫代硫酸钠滴定,滴至淡黄色,加1ml0.5%淀粉溶液,滴至无色,待30s,如试液仍为无色,即为终点。
2.空白测定 于250ml三角烧瓶中加入5ml蒸馏水,加0.5g碘化钾,溶解。用吸量管移入1∶3硫酸溶液1ml,混匀。用移液管移入10ml0.01N高锰酸钾溶液,混匀。
待高锰酸钾颜色褪尽后,加入100ml蒸馏水,混匀。用0.01N硫代硫酸钠溶液滴定,滴至淡黄色,加1ml0.5%淀粉溶液,滴至由蓝色转变为无色后,待30s,如试液仍为无色,即为终点。
3.标定硫代硫酸钠溶液的浓度标定方法与溶解氧测定相同。
(四)结果计算
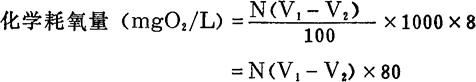
式中:V1-用硫代硫酸钠溶液滴定空白时的读数(毫升数);
V2——用硫代硫酸钠溶液滴定水样时的读数(毫升数);
N——硫代硫酸钠溶液的当量浓度。
(五)注意事项
1.此法氧化率较低,故测定时应严格控制各条件,如加热温度与煮沸时间等。
2.水样加热完毕后,应冷却至室温,方可加入碘化钾与硫酸,否则会因游离碘的挥发,使测定结果偏低。
十二、可溶性无机磷酸盐的测定
本测定采用以抗坏血酸为还原剂的磷钼蓝测定法。此法用于淡水、海水。淡、海水二者的测定方法原理是相同的,但二者所用有关试剂的配制及用量是不相同的。因此,下面分别介绍淡、海水的测定方法。
(一)测定淡水
1.仪器与器皿 分光光度计,1台。吸量管,5ml。容量瓶,50ml,200ml。三角烧瓶,150ml。移液管,20ml。
2.试剂及其配制
2∶1硫酸:在搅拌下,将两份浓硫酸徐徐加入1份水中,搅匀,冷却,盛于试剂瓶中。
钼酸铵-酒石酸氧锑钾溶液:称取钼酸铵〔(NH4)6MO7O24·4H2O〕6g和酒石酸氧锑钾(KSbO·C4H4O6·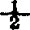 H2O)0.24g溶于300ml纯水中,加入120ml2∶1硫酸,混匀,再稀释至500ml,混匀,盛于聚乙烯瓶内保存。
H2O)0.24g溶于300ml纯水中,加入120ml2∶1硫酸,混匀,再稀释至500ml,混匀,盛于聚乙烯瓶内保存。
抗坏血酸溶液:称取7.2g抗坏血酸(C6H8O6),溶于100ml纯水中,盛于聚乙烯瓶中。在4℃下有效期为一周。
钼-锑-抗溶液:将上述钼酸铵-酒石酸氧锑钾溶液和抗坏血酸溶液按5∶1的比例(体积比)混合,混匀,此混合溶液有效时间为4h左右,临使用前适量配制。
磷酸盐标准贮备溶液:准确称取磷酸二氢钾(一级,预先在110-115℃烘1-2h,置于干燥器中冷却)0.2197g,溶于纯水中,转入1000ml容量瓶中,稀释至刻度,混匀。在低温暗处保存。此溶液含磷量为50.0μg/ml。
磷酸盐使用标准溶液:移取20.00ml磷酸盐标准贮备溶液,于200ml容量瓶中,稀释至刻度,混匀。此溶液含磷量为5.0μg/ml。
3.测定步骤
(1)制定工作曲线:在6个50ml容量瓶中分别移入磷酸盐使用标准溶液0,0.50,1.00,2.00,3.00,4.00ml,用纯水稀释至刻度,混匀,按序倒入6个干燥三角烧瓶内。
向上述各三角烧瓶内分别移入4ml钼-锑-抗混合溶液,混匀,放置15min,于700nm处测定其吸光值A。
在厘米方格纸上,以吸光值A为纵坐标,溶液中含磷量为横坐标作图,即得工作曲线。
表2-32 磷酸盐工作曲线数据记录表

(2)水样测定及结果计算:量取50ml水样于三角烧瓶中,加入4ml钼-锑-抗混合溶液,混匀,放置15min后测定其吸光值Aw。由水样的Aw值查工作曲线,即得该水样中磷(P)的含量。
4.注意事项 在测定前,水样需经0.45μm滤膜过滤处理。
(二)测定海水
1.仪器与器皿 参照测定淡水部分。
2.试剂及其配制
6N硫酸:在搅拌下,将60ml浓硫酸徐徐加于300ml纯水中,冷却,盛于试剂瓶中。
3%钼酸铵溶液:称取3g钼酸铵,溶于100ml纯水(如浑浊应过滤),盛于聚乙烯瓶中。
5.4%抗坏血酸溶液:称取5.4g抗坏血酸,溶于100ml纯水,贮于聚乙烯瓶中。有效期为一周。
0.136%酒石酸氧锑钾溶液:称取0.136g酒石酸氧锑钾,溶于100ml纯水,盛于聚乙烯瓶中,有效期为半年。
混合试剂:按序取100ml6N硫酸、40ml3%钼酸铵溶液、40ml5.4%抗坏血酸溶液和20ml0.136%酒石酸氧锑钾溶液于500ml烧杯中,每加一种溶液后均需混匀,盛于试剂瓶中。此混合试剂有效时间为6h,临使用前适量配制。
3N硫酸:量取200ml6N硫酸,倒入200ml纯水中,混匀,盛于试剂瓶中。
磷酸盐标准贮备溶液:准确称取0.4394g磷酸二氢钾(一级,预先在110-115℃烘1-2h,置于干燥器中冷却),溶于纯水,转移入1000ml容量瓶中,稀释至刻度,混匀。加1ml氯仿,混合。此溶液含磷量为100μg/ml。有效期为半年。
磷酸盐使用标准溶液:移取1.00ml磷酸盐标准贮备溶液于100ml容量瓶中,稀释至刻度,混匀。加2-3滴氯仿,混合。此溶液含磷量为1μg/ml。有效期为一周。
3.测定步骤
(1)制定工作曲线:在6个100ml容量瓶中分别移入磷酸盐使用标准溶液0,1.00,2.00,5.00,8.00,10.00ml,用纯水稀释至刻度,混匀,按序倒入6个干燥三角烧瓶内。向上述各三角烧瓶内分别移入10ml混合试剂,混匀,放置15min,于882 nm处测定其吸光值A。
在厘米方格纸上,以吸光值A为纵坐标,溶液中含磷量为横坐标作图,即得工作曲线。
表2-33 磷酸盐工作曲线数据记录表
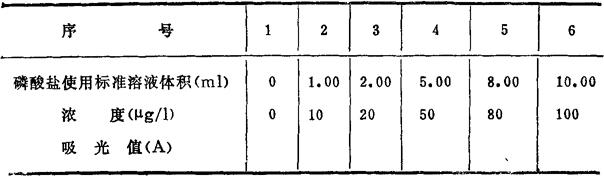
(2)水样测定:量取100ml水样于三角烧瓶中,移入10ml混合试剂,混匀,放置15min后,于882nm处测定其吸光值Aw。
量取100ml水样于三角烧瓶中,加10ml3N硫酸,混匀,测定水样浑浊的吸光值At。
(3)结果计算
An=Aw-At
式中:Aw——水样的吸光值;
An——水样中磷酸盐的吸光值;
At——水样浑浊吸光值。
由水样的An值查工作曲线,即得该水样中磷(P)的含量。
十三、总磷的测定
本测定采用过硫酸钾消解法。水中有机态磷和不同形式的磷酸盐,在过硫酸钾的作用下,转变为正磷酸盐。正磷酸盐在酸性介质中,可同钼酸铵和酒石酸氧锑钾反应,生成磷钼酸后,再被抗坏血酸还原,生成深色的磷钼蓝。然后测定其吸光值,从工作曲线查得水样中的含磷量。
此法用于测定淡水、海水的含磷量。对淡、海水二者的测定方法原理是相同的,但二者所用有关试剂的配制与用量是不同的。下面分别作介绍。
(一)测定淡水
1.仪器与器皿 除分光光度计外,其余部分参照总氮测定九、(一)。
2.试剂及其配制
过硫酸钾溶液:称取过硫酸钾(K2S2O8)4g溶于纯水中,稀释至100ml。
2∶1硫酸:与淡水磷酸盐测定相同。
钼酸铵-酒石酸氧锑钾溶液:与淡水磷酸盐测定相同。
抗坏血酸溶液:与淡水磷酸盐测定相同。
钼-锑-抗溶液:与淡水磷酸盐测定相同。
磷酸盐标准贮备和使用标准溶液:与淡水磷酸盐测定相同。
3.测定步骤
(1)制定工作曲线:在6个100ml容量瓶中,分别移入磷酸盐使用标准溶液0,1.00,3.00,5.00,10.00,15.00ml,用纯水稀释至刻度,混匀。
分别取上述各溶液50.0ml,移入消解瓶。各瓶溶液含磷量分别为0,2.5,7.5,12.5,25.0,37.5μg。加入过硫酸钾溶液10ml,摇匀后并密封。
将消解瓶放入压力锅或高压釜内,在120℃加热消解30min。消解后冷却,取出消解瓶,静置。
移取上层清液25ml于试管内,加入2ml钼-锑-抗溶液,摇匀,放置15min,于700nm处测定吸光值A,以试剂空白作参比。
在厘米方格纸上,以吸光值A为纵坐标,溶液中含磷(P)量为横坐标作图,即得工作曲线。
(2)水样测定:取适量水样(含磷量不超过0.06mg),装入消解瓶中,加水到50ml。
以下操作按上述制定工作曲线中的相应步骤进行操作。
测定水样吸光值,并从工作曲线上查出含磷量。
4.结果计算

式中:A——从工作曲线上查得的水样含磷量(μg);
V——加入消解瓶中的水样体积(ml)。
(二)测定海水
1.仪器与器皿 参照本测定中淡水部分。
2.试剂及其配制
过硫酸钾溶液:取7.5ml1∶1硫酸于烧杯中,用纯水稀释至100ml,将5g过硫酸钾(二级)溶于此溶液。贮存于聚乙烯瓶中,避免阳光直接照射。此溶液能稳定一周。
1∶1硫酸:在搅拌下,将1份浓硫酸徐徐加入1份水中,搅匀,冷却,盛于试剂瓶中。
3.25%酒石酸氧锑钾溶液:称取3.25g酒石酸氧锑钾于100ml纯水中,贮存于聚乙烯瓶中。
10%钼酸铵溶液:称取10g钼酸铵(二级)溶于90ml纯水中。保存聚乙烯瓶中。
混合试剂:将27ml钼酸铵溶液慢慢地加到36ml1∶1硫酸中,加3ml酒石酸氧锑钾溶液和35ml纯水,混匀,贮存于棕色玻璃瓶中。
10%抗坏血酸溶液:称取10g抗坏血酸(二级)溶于100ml纯水中,摇匀,盛于棕色试剂瓶中,并存于冰箱。此试剂至少可稳定一个月。
磷酸盐标准贮备和使用溶液:与磷酸盐测定十二、(二),2相同。
3.测定步骤
(1)制定工作曲线:在6个200ml容量瓶中,分别移入0,2。00,6.00,10.00,15.00,20.00ml使用标准溶液,用纯水或无磷酸盐海水分别稀释至刻度,混匀。其浓度分别为0,10,30,50,75,100μg/L。分别取上述溶液50ml注入消解瓶中。
在各消解瓶中分别加入3ml过硫酸钾溶液,盖紧瓶塞,并将其放至盛有300ml水的热压器中,热压处理30min。冷至室温后,查对塞子是否密闭,然后打开瓶盖,将溶液定量地转移到三角烧瓶中,分别加入1ml抗坏血酸溶液,摇匀,0.5min后再加入1ml混合试剂。
5min后,用880nm波长测定其吸光值(A)。
参照十二、(二),3.(1)步骤绘制工作曲线。
(2)水样测定:量取50ml水样注入消解瓶中,加3ml过硫酸钾溶液,盖紧瓶塞。
以下步骤参照上述制定工作曲线部分。测定吸光值(Aw)。
取1份50ml水样注入反应瓶中,加入3ml过硫酸钾溶液,盖紧瓶塞,热压处理0.5h,冷却至室温后,测定水样浑浊吸光值(At)。
4.结果计算
An=Aw-At
式中:Aw——水样的吸光值;
An——水样中磷的吸光值;
At——水样浑浊吸光值。
由水样的An值查工作曲线,即得该水样中磷(P)的含量。
(编者:李三庆 审者:雷衍之、黄仿元)