可可
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第705页(9447字)
可可(Theobroma cacao L.)种子或可可豆是制造可可和巧克力和提取可可油原料。可可属(Theobroma)是梧桐科(Sterculiaceae)的一员,有22种。可可是仅有栽培种。分成二个主群:Criollo和Forastero。Dublin(1972)首次取得可可单倍体幼苗(n=x=10)。是从多胚种子中分出的胚取得的,用幼叶鉴定了它为单倍体。栽培可可多胚平均1.55%,有2.7%多胚种子产生单倍体。单倍体频率与双胚种子形成有关连,其发生率为0-9%。在控制环境下发芽的平板豆也产生单倍体再生植株。自交不亲和Amazon型的推迟授粉,从单胚种子筛选幼苗都能产生单倍体。单倍体可可有独特表型。生长慢,叶小不规则,直立叶枝梗短,与二倍体叶的匍匐枝区别明显。一般只能生存5-12个月,嫁接在二倍体可可砧木上,可保持单倍体状几年。用秋水仙素溶液浸湿的小棉球放在4周龄植株顶端分生组织使染色体加倍成功。象牙海岸曾用二倍体化的单倍体与Amelonado亲本杂交,进行可可树的遗传改良。
(一)研究进展
一般言之,可可各种器官或外植体在广泛的培养基上都能有效地诱导产生愈伤组织,但再生植株的尝试都失败了。
Archibald(1954)首次研究可可组织培养,用White或Gautheret培养基不加生长调节剂,用树皮或茎外植体取得愈伤组织。形成层组织产生的愈伤组织持续继代所需营养成分比原始外植体的更为复杂。White培养基只能支持很慢的生长,加CW后能加速生长率。其初生愈伤组织紧密,白色和颗粒状,但继代在加CW的培养基上,变成无色。固体培养基培养的愈伤组织与培养在液体桥上的有相当大的差异。前者白色愈伤组织块逐渐为无组织淡棕色松散的颗粒状愈伤组织所遮盖。用液体培养基,生长限于培养物与滤纸桥接触的部分,由此原来的愈伤组织被新生愈伤组织凸出在纸的表面。还采用了膨茎病毒侵染植株的外植体启动和继代愈伤组织。
Ibanez(1964)用改进的Rudol.ph和Cox(1943)培养基研究不同糖类(蔗糖、六碳糖、麦芽糖、乳糖和山梨糖)对无子叶成熟胚(在无菌条件下)的呼吸作用的作用。
供试培养基中,以MS大多数外植体愈伤组织发育最好。加各种浓度的蔗糖、生长素、细胞分裂素和维生素试验结果,指出MS加11.0μM IAA,0.47μM KIN和2倍MS维生素愈伤组织生长最好。
变动IAA或NAA用量对愈伤组织生长有所改进。愈伤组织增长7周。以后下降,发生衰老。由此,采用了每隔8周继代一次。
用广泛的培养基加叶、荚壁、和幼种子提取液,测验愈伤组织的植株再生。除发生周期性根启动外,未见器官建成。
Orchard等(1979)和Miller(私人通讯)用可可顶芽研究营养繁殖。大多数植物的茎尖有间歇的休眠与生长的习性。温带种一次生长和休眠循环长达一年,而可可则在一年内能进行几次循环。他们取可可茎尖启动组织培养物,以建立适宜材料,供研究间歇芽生长的内在控制之用。从幼苗取顶芽,用0.1%氯化汞消毒,培养在LS加不同生长调节剂:KIN,ZEA,IAA,IBA和GA。测试了固体和振荡液培养基。
琼脂和液体培养基上都看到生长,但反应程度,视芽发育年龄和荷尔蒙处理而有异。琼脂培养基上的反应限于芽的吸胀,而某些液体培养基处理则芽吸胀后继之叶和茎伸长。KIN和GA有打破休眠的作用,表现为芽的吸胀和托叶开展。休眠芽培养结果,未能取得完整植株。
Miller培养腋芽和带腋芽的节,以保持可可的有组织的生长,尽可能不产生愈伤组织。任何茎切段放在加或不加生长调节剂的培养基上,都能形成愈伤组织。这种状态可能不利于启动和保持有组织的生长。Miller把外植体培养在MS加几种生长调节剂:IBA,ZAA,NAA,6BA,2iP和GA。并用SH,B5和LS培养基测验其影响。MS加IBA和KIN,打破了芽休眠,继之叶伸展和茎叶伸长。大多数情况,只打破休眠,芽终于死亡。
Esan(1975)和Pence等(1979)培养很幼可可胚的子叶和下胚轴组织,取得体细胞胚。Esan(1975)用许多外植株如6-8周龄果实的胚珠,90天龄果实的未成熟胚,成熟未裂荚的胚轴(可可豆的轴)和花药。培养茎是MS无机盐类,WH维生素和CH。花药培养在Nitsch培养基上,以找出产生再生植株方法。
Esan(1975)报道,有些生长物质能激活胚的特定部分的生长反应。例如,tryptone100-1000mg/l能加强子叶的生长,比其它组织为好。NAA促进直接体细胞胚胎发生,而不是根生长。继之产生的不定芽,是球形或钟形,由出芽过程发育而成。大多数体细胞胚是从幼苗芽的下胚轴产生的,有些从子叶近轴部分产生。这些不定胚的启动,并未经愈伤组织形成。
Pence等(1979)研究可可再生植株所需离体培养条件。采用叶、果皮、胚珠,未成熟胚,成熟胚的子叶和轴,培养在不同培养基,以测验形态建成潜势。基础培养基含有MS盐类,肌醇0.55mM,烟酸4.1μM,盐酸吡哆醇2.4μM,盐酸硫胺素0.03μM,甘氨酸0.03mM,CH 1000mg/l,蔗糖0.088M,琼脂10g/l,和CW 100ml/l。三种细胞分裂素:KIN 0-43uM,2iP 0-98μM,和BA 0-88μM和三种生长素:IAA0-110μM,NAA 0-110uM和2,4-D0-90μM配合使用。培养体培养在26℃,光暗和黑暗二种。
全部供试外植体实用上全部供试培养基都取得愈伤组织。加NAA时,从叶未成熟胚和成熟子叶外植体产生根,无论光和暗培。未成熟有性胚培养在加NAA和CW的基础培养基上,光或暗培,产生了不定胚,从其子叶出芽增殖产生的。当从固体培养基转入振荡的液体培养时,这些不定胚发育成根,其中有些取得初生叶生长。未见继续生长成正常再生植株。有些处理,有性胚的子叶有80%启动了无性胚(表26-13)。
表26-13 可可未成熟子叶的无性胚增殖2(Pence等,1979)

a.培养在基础培养基加CW和NAA18天后。
Jalal等(1977,1979)提出用可可愈伤组织研究多酚类和香味化合物的生物合成。有些多酚类愈伤组织和活体组织都含有,愈伤组织内发现许多多酚类为完整植株所未曾见到的。
Jalal等(1979)提出子叶和茎外植体产生愈伤组织和悬浮培养物的继代培养方法,以研究可可香调的原料原的价值(表26-14,26-15)。测验二者的香调的特种组分如类黄酮和甲基化嘌呤的生产。MS加4.9μM IBA和0.23μM ZEA取得旺盛生长。
表26-14 Amazon和Amelonado可可幼苗培养在White培养基加CW的下轴胚外植体光对平均愈伤组织启动的影响
(Hall和Collin,1975)

表26-15 Amelonado可可幼苗下胚轴外植体培养在White培养基加CW,温度对平均愈伤组织启动的影响
(Hall和Collin,1975)

Hall等(1975)观察到愈伤组织启动期间,Amazon可可外植体启动愈伤组织较Amelonado可可的为早(表26-16)。由此可设想Amazon可可植株的离体培养下生长与活体优越旺势有相关。果能应用于所有品种,则愈伤组织生长状态可用于测验旺势,在早期世代就可用以植株选择。
表26-16 Amazon和Amelonado可可幼苗下胚轴、根、茎、子叶外植体培养在不同营养培养基10周后的愈伤组织生长
(Hall和Collin,1975)
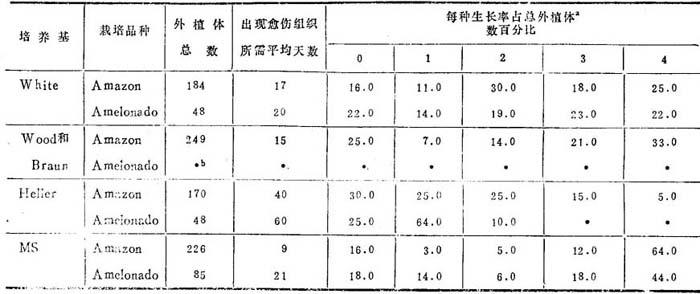
a.每种外植体愈伤组织生长的记载系统
0=无愈伤组织
1=只在切面出现愈伤组织
2=愈伤组织复盖切面,根外植体有根瘤
3=愈伤组织长在切面上,出现在未受伤表面
4=愈伤组织全面覆盖外植体
b.全部培养物被污染
Prior(1977)用可可愈伤组织研究植物病理学。担子菌(Oncobasidium theobromae)是可可维管束病的病原菌,有生命愈伤组织设想是这种真菌的最适生长培养基。MS加2,4-D和KIN的愈伤组织培养体能支持O.theobromae生存。从花药或从成熟胚轴切段取得愈伤组织。培养在25℃,间歇光照,每天12h。每隔4-5周继代一次。愈伤组织生长率视无性系而异。O.theobromae菌丝在可可愈伤组织生长旺盛,显微镜观察菌丝生长在细胞间,由此可可愈伤组织可用于相应的致病真菌的生长,尤其是营养要求尚属不知的真菌。
(二)培养程序
可可愈伤组织诱导,几乎全部外植体在广泛培养基类型上,不同生理条件温度光强和光同期都能取得。其困难于外植体污染问题。温室生长的植株轻于大田。采用无菌幼苗下胚轴切段,花芽的子房壁,成熟和未成熟英的果皮切段、成熟和未成熟胚的子叶切段作为外植体源结果较好。
1.完整荚为外植体 当用新收获的成熟荚启动的可可幼苗的无菌培养物很容易建成。
(1)荚果柄基部切下后,用自来水洗荚果,滤纸吸干,乙醇火焰烧,浸入10%次氯酸钙1h或以上。英面的蜡质膜阻碍次氯酸盐渗入果皮内部。
(2)在超净台上把荚果切开。剥去种皮,把种子浸入8%次氯酸钙20min,无菌水淋洗3次。由于外壳的保护子叶和种子根端和胚保持不受次氯酸钙的损伤。
(3)然后把种子放入试管(长200-250mm),装20ml培养基:MS0.058-0.088M蔗糖,7g/l琼脂,pH5-6。
(4)放入27℃培养室,4-5周发芽,25%种子发育成无菌幼苗,长至足供切段成为外植体。营养培养基有助于检测种子的污染。
2.成熟和未成熟英果皮作为外植体
(1)消毒程序同上。
(2)超净工作台上把果皮切成大块。除去表皮和内果皮肉质部分后,果皮切成lcm小切段。
(3)把切段放入试管内含MS无机盐类,维生素:12mM泛酸钙,0.55mM肌醇,8.1μM烟酸,3.0μM盐酸硫胺素,5.0μM盐酸吡哆醇,0.04mM生物素,0.088M蔗糖,2.3-4.5μM2,4-D,4.4μM BA,或4.6μMZEA。
(4)暗培,25-27℃,培养4-6周出现愈伤组织。
(5)愈伤组织继代在愈伤组织启动培养基上,保持,暗培或光培。
还有几种培养基组合,能以诱导可可各种外植体的愈伤组织。
(三)展望
可可是热带国家最重要经济作物,其细胞培养技术实际应用,仍然是处于“处女”的研究阶段,急待开发。可可的各种组织在多种培养基上反应良好,愈伤组织培养体可长期保持活力。可用作真菌培养的活性基质,有利于鉴定抗病品种的研究。Prior(1982)报道Oncobasidium属担子菌能在可可愈伤组织上生长。但顶芽和腋芽培养微繁殖至今尚未成功。幼合子胚子叶和下胚轴组织的出芽,发育成细胞胚,但试图取得再生植株也未成功。未成熟合子胚的体细胞胚胎发生可用于克服异种间杂交杂种胚早期败育。花药和胚珠培养仅能取得从其二倍体组织产生的愈伤组织。有时生根。
可可组织培养用于作物改良,多数研究失败了,但这些技术对栽培可可的遗传改良非常有用,如营养繁殖,异种杂交,产生同质植株,取得无病毒植株,建立有用基因型的微种质库,了解生理发育和各种的生物合成。并可增进国际交换。可可自发单倍体频率1%(Amazon群)或零(Amelonado或Trinitanio群),花药或胚珠培养诱导单倍体性十分有助于植物育种家取得大量同质植株。凡此都证明着可可细胞培养植物再生技术(通过器官建成胚胎发生)的重要性。
【参考文献】:
〔1〕Agrawal,S.and N.Chandra 1983 Differentian of multiple shoot buds and plantlets in cultured embryos of C.annuum var.Mathani.Curr.sci.52∶645-646.
〔2〕Dumas DeVaulx,R.D.Chambenett and M.Sibi 1981 Culture in vitro d′antheres de piment(Capsicum annuum)∶Amelioration de laux d′obtention de plantes-chez diffenert genotypes par de traitments A+35℃,Agronomie 1∶859.
〔3〕Gunay,S.and P.S.Rao 1978 In vitro Plent reganeration from hypocotvl and cotyledon explants of red pepper(Capsicum).plant Sci.Lett.11∶365-372.
〔4〕Saxena,P.k,R.Gill,A.Rashid and S.C.Maheshwari 1981 Isolation and culture of protoplasts of C.ann uumL.and their regeneration into plant flowering in vitro.Protoplasma 90∶357-360.
〔5〕Sibi,M.,R.Dumas De Vaulx and D.Chambooett.1979 Ubtention de plantes haploides par androgenese in vitro chez le piment(Capsicum annuum).Ann.Amelior.plant 29∶583-606.
〔6〕Sondahl,M.R.,D.A.Spahlinger,and W.R.Sharp 1979 A histological study of high frequency and low frequency induction of somatic embryos in cultured leaf explants of Coffea arabicaL.Z.pflanzenphysiol.94∶101-108.
〔7〕Sondahl,M.R.,L.S.Caldas,S.B.Maraffa and M.R.Sharp 1980 The physiology of in vitro asexual embryogenesis.In∶Horticultural Reviews(J.anick,ed.)pp.268-310.AVI Publ.Westpart,Connecticutt.
〔8〕Sondahl,M.R.,L.C.Monaco,and M.R.Sharp 1981.In vitro methods applied to coffee.In∶Tissue Culture and its Application in Agriculture(T.Thorpe。ed)pp.325-358.Academic Press,New York.
〔9〕Staritesky,G.1970 Embryoid formation in Callus cultures of coffee.Acta Bot.Neerl 19:509-514.
〔10〕De Greef,W.and M.Jacobs 1979 In vitro culture of the sugar beet.Description of a cell fine with high regeneration capacity.Plant Sci Lett.17:55-61.
〔11〕Hosemans,D.and D.Bossoutrot 1983 Induction of haploid plants in vitro culture of unpollinated beet ovules(Beta vulgaris L.)Z.pflanzen zuchtg.91:74-77.
〔12〕Hussey,G.and A.Hepher 1978 Clonal propagation of sugar beet plants and the formation of polyploids by tissue culture,Ann.Bot 42∶447-478.
〔13〕Saunders,J.W.1982 A flexible in vitro shoot culture propagation system for sugar beet that includes rapid floral induction of rancetes.Crop.Sci.22:1102-1105.
〔14〕Heinz,D.J.,M.Krishnamurthi,L.G.Nickell,and A.Maretzki 1977 Cell,tissue and organ culture in sugarcane improvement.In∶Applied and Fundamental Aspectsof plant cell,Tissue and Organ Culture(J.Reinert and Y.p.S.Bajajeds)pp.3-17.Springeo-Verlag,Berlin.
〔15〕Larkin,P.J.and W.R. Scowcroft 1981 Somaclonal variation∶A novel source of variability from cell cultures for plant improvement Theor.Appl.Genet.60∶197-214.
〔16〕Liu,M.C.1981 In vitro methods applied fo sugarcane improyement.In: Plant Tissue Culture∶Methods and Applications inAgriculture.(T.A.Thorpe,ed.)pp299-323,Academic press,New York.
〔17〕Reinert J.and Y.P.S Bajaj(eds.)1977 Applied and Fundamental Aspects of plant cell,Tissue and Organ Cultures,Springer-Verlag.Berlin.
〔18〕Stevenson,G.C.1965 Genetics and Breeding of Sugarcane.Longmans,Green and Co..London.
〔19〕Thorpe,T.A(ed.)1981.Plant Tissue Culture∶Methods and applications in Agriculture.Academic Press,New York.