豆类饲草
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第451页(31048字)
三叶草(Trifolium)是温带地区饲草和土壤改良重要作物。约有250种。其中白三叶(T.repens L.)是主导作物。近年来某些三叶草和百脉根离体培养发展和应用有显着进展。自交不亲性,具有对立的s等位基因系统,自交严重减退,是克隆繁殖作物。染色体数n=5.8。
(一)组织和细胞培养系统发展
1.技术学
(1)红三叶 Niizeki和Kita(1973)用Miller培养基加17μM IAA+6.6μM BA形成愈伤组织,未见形态建成发育。显微镜观察指出愈伤组织来自体细胞组织。Nakrzewski等(1976)用Gautheret(1955)大量盐类、Burkholder等(1949)改进的微量盐类、Gaut-heret(1955)改进的有机组成和各种组合的2,4-D,IAA,NAA,KIN和玉米胚乳。9μM 2,4-D+15%玉米胚乳取得愈伤组织生长,并指出基础培养基缺乏未规定的营养因素。Rao(1976)用红三叶品种和二个育种系的根、茎、叶组织培养在Miller+9μM 2,4-D+10μM KIN。愈伤组织悬浮在相同培养液+共生菌系Rhizobium trifolii Daneg,继之悬浮在不加 ,2,4-D和KIN培养液中。6-8周,各种外植体有75%生根。未经菌种接种的,未见形态建成。得出结论接种培养体中Rhizobium产生和释放的荷尔蒙使红三叶愈伤组织的根形成。
,2,4-D和KIN培养液中。6-8周,各种外植体有75%生根。未经菌种接种的,未见形态建成。得出结论接种培养体中Rhizobium产生和释放的荷尔蒙使红三叶愈伤组织的根形成。
Ahoowalia(1976)培养四倍体cv.种子在MS+7.5μM 2,4-D,37μM IAA,10μM KIN。6内有63%产生愈伤组织。经转入无生长调节剂 ,取得了球形、心形和鱼雷期体细胞胚。未能植株再生。
,取得了球形、心形和鱼雷期体细胞胚。未能植株再生。
3-4年内红三叶愈伤组织和细胞培养进展显着。Beach等(1979)从培养在B5每种+10μM 2,4-D,NAA和KIN的2个cvs.的幻苗下胚轴和离体雌蕊建成了愈伤组织培养体。下胚轴产生的较多于雌蕊。不加2,4-D愈伤组织产生很差。有时产生茎芽。4-5周后,将愈伤组织转入B5+2倍于正常浓度的硫胺素,10μM NAA和15μM ADE。发育成许多芽,但很少生根。培养在B5+高浓度硫胺素+1μM NAA的芽生了根。IAA,2ip或BA组合效果差。SH是B5的相宜代换培养基。MS和Blaydes(1966)基础培养基不能支持愈伤组织生长。B5+CV或叶提取液未见改进。大多数再生植株生长正常,是可育二倍体。也有少数反常的不育植株。
Phillips等(1979)研究了栽培品种幼苗切段愈伤组织生长。指出0.25μM PIC和0.44μM BA组合最适于启动愈伤组织和增殖。设计了L2培养基,其组成为MS主盐类,降低NH4+浓度,增高PO43-,K+,Mg2+和Ca2+浓度。SH的微量元素,调整几种盐类浓度。用LS的有性成分(维生素和蔗糖),增高硫胺素和肌醇用量。烟酸能抑制愈伤组织生长。L2与MS无机成分培养体鲜重无统计差异,但比其它供试培养基SH和Miller无机成分的为好。L2适用基因型范围较广。L2无机成分对紫苜蓿和大豆比MS,SH,和Miller成分有统计上的优越性。
Collins等(1982)用常规发芽的幼苗为外植体,培养在L2仅含10%主盐类浓度,25%维生素浓度和60%蔗糖浓度和0.65%琼脂以产生愈伤组织。Phillips等(1979)用成熟和未成熟营养体和生殖外植体组织培养在L2取得旺势愈伤组织。愈伤组织培养体再生了植株。再生频率视组织来源和cv.而定。有30-80%基因型从分生组织产生愈伤组织再生,而从非分生组织愈伤组织再生植株的只有1%基因型。花药产生的愈伤组织频率低但高度形态建成。Altaswede和Arlington品种愈伤组织再生植株比Redman,Kenstar和Tensas品种为多。培养在2,4-D,NAA,CPA,PIC,BA和KIN各种组合的愈伤组织都能再生植株。包括2,4-D的组合,比PIC和BA组合,产生更多植株。将生长在含2,4-D培养基的愈伤组织转入含低浓度PIC和高浓度BA培养基,再生植株效率更高。植株移入 +烟酸和类维生素衍生物——3氨基吡啶生根。全部再生植株是正常状态二倍体。
+烟酸和类维生素衍生物——3氨基吡啶生根。全部再生植株是正常状态二倍体。
Phillips等(1979)用L2培养液成功地取得红三叶细胞悬浮培养体。细胞分裂速率很快。当转入固化L 2取得愈伤组织集团。未见再生植株。Phillips等(1980)进一步研究中,从细胞悬浮培养体产生愈伤组织再生植株成功。选取一个cv的3株幼苗,切段后培养在SL2液体培养基以启动细胞悬浮体。SL2是降低L2的某些主盐类浓度和全部微量元素。在启动再生前,把细胞悬浮体每周系列地继代三种生长调节剂组合上:0.25μM PIC,0.44μM BA,0.9μM 2,4-D,和25nM PIC,或0.45μM 2,4-D和15μM ADE,6个月,从三个细胞悬浮系转入各组合IAA,NAA,PIC,2,4-D,BA和ADE的固化L2培养基,以产生愈伤组织供再生研究。各种生长调节剂组合间对细胞悬浮体和植株再生均无统计上差别。不同细胞分裂素间也如此。不同生长素间有统计上差异,2,4-D对再生植株最好。2,4-D用量有重要性,23nM-0.14μM比其它浓度为好。基于数量差异,得出结论SL2+0.25μM PIC和0.44μM BA是保持细胞悬浮体的最好培养基。L2+45nM2,4-D和15μM ADE最适于启动植株再生。从再生发育模式,可证明通过体细胞胚胎发生再生植株。在发育成三小叶叶前,从体细胞胚长成子叶和单小叶叶。有些体细胞胚在诱导培养基上,发育成完整芽和根。大多数体细胞胚在L2+低PIC和中等BA上芽发育效果最好。大多数再生植株正常和,或不育。约10%是四倍体,设想在培养期间染色体自发加倍了。其它基因型产生愈伤组织对再生程序也有反应,有些愈伤组织虽需在诱导培养基上多次继代,以利启动体细胞胚胎发生。
Phillips等(1981)研究磷素效应的细胞选择方案中,采用细胞悬浮体和植株再生的三种程序。在系列继代中,把二个基因型培养在逐渐降低磷浓度培养基上。标准水平为1.8mM。含磷0.1mM培养基有50%增高了细胞加倍速度。继之,就持续在1.8mM磷生长4-12月细胞进行选择。选出比未经选择的细胞加倍速度增约3倍。将选出的细胞放回标准用量,能立即再次适应选择条件。测定了选和未选细胞含磷和总氮量。一个基因型的选出细胞回放在标准生长条件时,表现出磷和氮含量显着较高于未选细胞。这个系的再生植株的磷、氮含量也较高。其磷含量比其它红三叶植株高2-3倍。
Keyos等(1980)评价了红三叶愈伤组织培养体遗传变异。在大多数人工培养产生的特性,包括愈伤组织生长很快,克隆团的维管束化、根启动、叶绿素含量和体细胞胚胎发生,加性遗传变量是变异性的明显来源。这些性状具有高度可遗传性。得出结论,研究组织培养,这些性状能在培育和选择优良群体起一定作用。其中少数是显性。有些情况下,仅在供试的二种再生培养基中的一种上表现显性遗传变量。在早期继代中,母性和细胞质因子有重要作用。在二种再生培养基上,有12种性状包括体细胞胚胎发生的加性遗传变量间表现显着相关。结论是在两种再生培养基上,有一些共同基因涉及相关的表象。
Phillips(1979)提出另一些人工培养方法。从合成的Kenstar品种10%无性系,用芽分生组织培养以消除病毒。从冠芽切取直径0.1-0.4mm的含第一叶原基的分生组织顶帽。接种在L2+6种组合的PIC和BA。16nMPIC和4.4μM BA组合产生芽生长和发育。不加PIC未见生长。PIC浓度较高产生愈伤组织。不加BA生长很差。0.44μMBA产生的芽比较高浓度BA的少得多。在供试最适培养基上,约85%较小外植体生芽。较小外植体产生的芽,有85%无病征,而较大外植体的只有50%是无病芽。芽培养在 +全强KH2PO4和铁,8.5μM烟酸,24μM3-氨基吡啶和1.2μM IAA诱导生根。进一步研究,发现12nM PIC+2.2μM BA最适于多数基因型。改进L2适于加速克隆繁殖和消除病毒。并不生愈伤组织。几个月内产生成百个芽。再生植株与亲本相似。
+全强KH2PO4和铁,8.5μM烟酸,24μM3-氨基吡啶和1.2μM IAA诱导生根。进一步研究,发现12nM PIC+2.2μM BA最适于多数基因型。改进L2适于加速克隆繁殖和消除病毒。并不生愈伤组织。几个月内产生成百个芽。再生植株与亲本相似。
Cheyne等(1980)用二倍体和四倍体品种的0.2-0.7mm茎尖,培养在B5或Blaydes+1.2μM ZAA+0.9μM2ip,再生频率为67%。但在芽基部长有愈伤组织。加2,4-D和KIN或NAA的培养基,愈伤组织产生更多。冷藏(2-6℃)15-18月的茎尖培养体,当放回标准条件再生植株成功。移栽土中成活率80%以上。观察200以上植株未见反常性。
Skucinska等(1980)提出未成熟花序无性繁殖方法。培养在MS+0.5μM IAA+22μM BA有10%未污染花序再生植株。每月芽数增高系数约为2-4。不加生长调节剂培养基上取得生根。加30μMIAA会有所抑制。8个月产生约1000株。全部正常。花序培养必需在生芽前改变其分化状态,而茎尖培养易于保持其遗传稳定性。
Kein(1953)培养红三叶授粉后8天未成熟胚,用Randolph等(1943)的简单营养琼脂培养基。取得了成熟正常植株。四倍体红三叶草与Zigzag红三叶草(T.medium L.)正反交不能产生胚供培养之用。二倍体红三叶和T.alpestre L.(♀)取得一个胚,但已退化,对培养无反应。
Evans(1962)采用上法培养红三叶草×Zigzag三叶草,T.rubens L.,T.alpestre,绛三叶草,野火球和杂种三叶草,试图拯救杂种胚。有些情况下,选用了二倍体和四倍体亲本。取授粉后8-15天胚,在培养基上发育不正常,未得杂种植株。结论:种间杂交不亲和性的致因,是由于胚乳发育反常,不能为发育中胚提供营养。设想改进培养基可能改进胚发育。Phillips等(1982)用二倍体×T.sarosiense Hazsl.(2n=48)未成熟杂种胚培养取得成功。授粉后12-19天取胚培养在L2+0.365M蔗糖,25nM PIC,和15μM ADE8-14天,取得心形期杂种胚。把成活胚转入L2+73mM蔗糖(标准用量),4nM PIC,和0.66μM BA,从胚直接发育成芽。较高浓度PIC或BA,形成愈伤组织,促进失去组织化能力。用上述诱导体细胞胚胎发生培养基,有些愈伤组织再生植株。促进杂种胚直接芽发育的培养基,也能促进体细胞胚发育。采用上述茎尖繁殖培养基,所有杂种胚能迅速繁殖,每月芽数增加4-10倍。用了这些程序拯救了约10%杂种胚。
杂种植株表现父本(红三叶)叶斑特性,这是母本所未有的。染色体31。由于减数分裂中止早,表现不育。杂种与父本回交,产生很少球形和心形胚。提出了胚拯救程序能用于助成回交世代。Collins等(1981)用同样方法取得红三叶×Zigzag三叶和T.alpestre杂种胚。这些结果指出采用改进的胚拯救程序的潜在应用价值,以产生前所不能取得的红三叶种间杂种。兹将主要成果列如表20-1。
表20-1 红三叶草离体培养技术主要成果

(2)白三叶 Pelletier等(1971)培养白三叶幼苗子叶,愈伤组织生长在MS大元素,Heller微量元素,B维生素,琼脂0.17M葡萄糖,0.9μM 2,4-D和0.5μM KIN。6周后愈伤组织转入0.5μM NAA,0.5μM KIN和10%CW。将出现组织化愈伤组织转入不和不加CW的相同培养基,取得了许多再生植株,转到稀释的营养培养基加0.56M葡萄糖和50nM NAA诱导生根。观察了42再生株染色体数。有些是细胞嵌合体。4株是正常组成32;4株30;2株62染色体。许多植株是单小叶而不是三叶,并与染色体数无关。观察到其它形态变异,尤其是非整倍体。
Oswald等(1977)取一种cv.2日龄幼苗培养在改进的Miller基础培养基+2μM维生素E,20μM 2,4,5-T,和6.5μM KIN,以诱导愈伤组织。并用于建成细胞悬浮培养体,Miller+2.3μM 2,4-D和0.5μM KIN,取得愈伤组织,移入Miller+2μM 2,4-D和4.6μM KIN但不加维生素E。在50培养体中,37生芽,3-4周内产生茎叶和根。由于再生了完整植株,可设想是由体细胞胚胎发生再生的。并注意到正常浓度螯合铁有利愈伤组织生长,2倍于正常铁浓度适于细胞悬浮体生长,植株再生则以正常铁浓度为宜。加维生素E促进细胞悬浮体内细胞分散。
Rupert和Sao(1977)用T.ambiguum Bieb.×白三叶杂种胚愈伤组织。授粉后7天从母株解剖取出胚珠,培养在MS+9μM2,4-D。10天后,从胚珠取出增大的胚,培养在同样培养基诱导愈伤组织。在培养基+1μM NAA和21μM 2ip上的愈伤组织培养体的再生植株能力至少保持3年。
Parrot等(1982)采用Phillips等(1979,1980)培养红三叶方法和诸培养基,成功地取得白三叶愈伤组织和细胞悬浮培养体。供试20基因型有20%生根。细胞悬浮体生长比红三叶更慢,细胞趋于成团。其生长比亲本愈伤组织更旺盛。发育成茎叶但未见再生植株。
Gresshoff(1980)取一个品种幼苗切段培养在B5或MS+0.5μMKIN和4或10μM2,4-D。高浓度2,4-D诱导产生愈伤组织,有无0.1%CH无关重要。培养最初2个月期间,愈伤组织上有根的发生。用生长在液体B5+μM∶0.25 KIN,22,4-D和0.1% CH,或50nM KIN,42,4-D和0.05%CH的愈伤组织启动细胞悬浮培养体。在诱导培养基,细胞悬浮体产生愈伤组织。用0.25M甘露糖醇,0.25M山梨醇,2mM CaCl2,5mMKH2PO4,2%Cellulysin,2%R10纤维素酶和1%driselase,pH5.8-6.0,从细胞悬浮体分离原生质体。在愈伤组织培养基上从原生质体产生愈伤组织。从所有来源取得的愈伤组织培养2年,在MS+2μM2ip和0.5μM NAA上生芽。当将出芽中的愈伤组织转入 产生了芽和增殖。培养在MS+1μM2ip和15μM IAA,从茎叶、芽和愈伤组织诱导生根。
产生了芽和增殖。培养在MS+1μM2ip和15μM IAA,从茎叶、芽和愈伤组织诱导生根。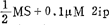 和0.5μM IAA取得再生植株锻炼。大多数常能移栽成活。有些植株表现小叶数变异(1,2,和3小叶),但经细胞学测验的13株染色体数正常32。
和0.5μM IAA取得再生植株锻炼。大多数常能移栽成活。有些植株表现小叶数变异(1,2,和3小叶),但经细胞学测验的13株染色体数正常32。
Oswald等(1977)研究细胞悬浮培养体耐除莠剂特性。采用上述相同材料和培养程序。在18μM2,4-D,38μM2,4,5-T和8μM4-(2,4-二氯苯氧)酪酸(2,4-DB)上评价了三种苯酚衍生物,比较其除莠剂活性。每种衍生物预处理细胞悬浮体5天。然后评价预处理的和对照培养体对三者的耐性。预处理显着有效,表现耐性。维生素E能加高选择效率,尤以对2,4-DB为甚。开始处理时,培养体的除莠剂敏感性有差异。继续培养生存细胞成为稳定化培养体。指出已产生了适应性。
Barnett等(1975)用Tillman白三叶草6个亲本克隆的匍匐枝分生组织顶尖(含有2个叶原基)培养以消除病毒。培养基MS+0.15M蔗糖,0.5%琼脂,和0.06nMIAA。约9%成活培养体长到成熟。经广泛寄主植物生物检测,近于60%再生株无病毒,而全部亲本克隆至少含有一种病毒。Cheyne等(1930)用于红三叶无性繁殖和冷藏的相同方法,培养2个白三叶草品种的茎尖,指出Blaydes优于B5。芽基部形成的有些愈伤组织,有80%产生再生植株。移栽入土成活90%以上。
Richards等(1980)发现改进的MS+2.9μMIAA和4.5μM2ip,能加强培养的胚的芽增殖。产生了一些愈伤组织。Parrott等(1982)用培养红三叶方法和Collins等(1982),培养白三叶幼苗茎尖。芽增殖很快愈伤组织很少或没有产生。
Keim(1953)培养白三叶未成熟胚,用红三叶培养方法,取得成熟植株。切取授粉后15天的胚(白三叶×T.nigrescens)和培养。取得成熟杂种植株。Evans(1962)培养白三叶×T.nigrescens,漆姑草三叶,T.unif!orum L.,亚利山大三叶草,地中海三叶(T.subterraneum L.)和T.arvense L.。采用红三叶同样培养程序。取得白三叶×Tnigrescens和T.uniflorum的杂种植株。
Williams(1978)从白三叶×四倍体Kura三叶授粉后14-16天的心形胚培养,把看护胚乳移植其上。培养基是改进的White(1963)大元素,MS微量元素,Kanta和Maheshwari(1963)有机成分。看护胚乳取自用正常四倍体Kura三叶授粉后8-9天的胚乳。把正常Kura三叶胚切除,杂种胚放在胚乳上,然后培养在固化培养基上的滤纸桥上。4-6个月,约10%杂种胚产生再生植株。根据特定染色体具有锤体,中间性形态和电泳谱带鉴定杂种性。Williams等(1980)综述了看护胚乳技术用于拯救杂种胚。用正常白三叶胚乳也取得了Kura三叶×白三叶杂种。白三叶×T.uniflorum曾产生成熟杂种植株。用Bourgin和Nitsch(1967)培养基+0.5μM NAA或IAA也取得成功,且效果更好。Gresshoff(1980)培养配方效果较差,但取得植株。供试培养基与胚乳来源同样重要,提出正常胚乳不能为拯救杂种胚提供所需全部因子。
Rupert等(1980)利用规定培养基拯救若干异种杂种成功,如白三叶×Kura三叶,T.nigrescens,T.uniflorum和T.isthomocarpum Brot.。后者曾取得单向杂种,胚培养拯救反交杂种。T.michelianum×白三叶未获成功。
Richards等(1980)提出人工授粉和培养子房程序。为了取得白三叶受精和胚发育,必须将萼片和花柄接着在子房上。Kura三叶×白三叶杂交后,培养带有部分花器官的子房中胚发育,与活体上发育很相平行。MS+生长调节剂有所助益,但胚发育改进不大。
白三叶离体培养结果综述如表20-2。
表20-2 白三叶草离体培养效果

a.未见肯定报道,系从以前报道推断的。
(3)其它三叶草 Graham(1968)用地中海三叶草种子培养在改进的MS(附加4mM烟酸)+0.2μM KIN和1μM 2,4-D,诱导愈伤组织形成。愈伤组织保持在相同培养基上。用同样培养基培养细胞悬浮物。用Rhibobium trifolii接种培养物,对生长并无影响。未见形态建成。
Schenk等(1977)用Alsike三叶草幼苗培养在SH+2.2μM 2,4-D,11μM CPA和0.5μM KIN取得愈伤组织。未报道形态建成。Mokhterzadeh等(1978)培养Berseem三叶草幼苗下胚轴,MS+各种组合的IAA,NAA,2,4-D,2ip,BA和KIN。以5.5μMNAA和7.5μM KIN最好。对2,4-D很敏感。愈伤组织转入11μM NAA和0.45μM 2ip继续繁殖。愈伤组织培养在11μM NAA和0.9μM 2ip培养液中建成细胞悬浮物。转入固化同样培养基后,长成愈伤组织克隆。未成熟花药培养在加5.5μM NAA,0.45μM 2,4-D和45nM 2ip培养基上产生愈伤组织。在2.7μM NAA和2.5μM KIN培养基上全都生芽,其它组合效率较低。芽生根培养基含5.7μM IAA和0.44μM BA。植株移栽温室。细胞学观察指出下胚轴愈伤组织和细胞悬浮物产生二倍体植株。花药培养再生单倍体,但未经证实和重现。
Beach等(1982)采用Phillips等(1979,1980)和Collins等(1982)用于红三叶培养程序,培养大Hop三叶草(T.campestro Schreb),地中海三叶草、深红三叶草,弯曲三叶草,T.alpestre和T.rebens。大Hop三叶草茎尖培养无反应,T.alpestre、深红三叶草、T.rubens和地中海三叶草快速无性繁殖。后者在茎尖培养中很快产生复芽。弯曲三叶草在标准培养基上产生愈伤组织和芽,用 正常浓度的PIC作为生长素。地中海三叶草在标准生根培养基上生根很盛。只用水时,其它种常见生根。地中海三叶草、大Hop三叶草和T.alpestre愈伤组织生长差,出现不同程度坏死。L2对此超适。约20%T.alpestre基因型在愈伤组织变褐色前生根。大Hop三叶草有局部生存,增殖慢。弯曲三叶草和T.rupens愈伤组织生长较红三叶草为旺盛。而深红三叶草的生长较慢,但有些发育成芽和根。T.alpestre,深红三叶,弯曲三叶草和T.rupens愈伤组织启发的细胞悬浮体生长很快,产生了愈伤组织无性系。T.alpestre和弯曲三叶草生芽但未再生植株。有
正常浓度的PIC作为生长素。地中海三叶草在标准生根培养基上生根很盛。只用水时,其它种常见生根。地中海三叶草、大Hop三叶草和T.alpestre愈伤组织生长差,出现不同程度坏死。L2对此超适。约20%T.alpestre基因型在愈伤组织变褐色前生根。大Hop三叶草有局部生存,增殖慢。弯曲三叶草和T.rupens愈伤组织生长较红三叶草为旺盛。而深红三叶草的生长较慢,但有些发育成芽和根。T.alpestre,深红三叶,弯曲三叶草和T.rupens愈伤组织启发的细胞悬浮体生长很快,产生了愈伤组织无性系。T.alpestre和弯曲三叶草生芽但未再生植株。有 供试T.rubens基因型细胞悬浮体愈伤组织通过体细胞胚胎发生再生植株。移栽大田。结果指出改进红三叶草培养程序可适用于其它三叶草种。
供试T.rubens基因型细胞悬浮体愈伤组织通过体细胞胚胎发生再生植株。移栽大田。结果指出改进红三叶草培养程序可适用于其它三叶草种。
Keim(1953)从Kura三叶草×Alsike三叶草和T.nigrescens授粉后15天未成熟胚培养,首次取得拯救成功,用Kura三叶草为母本,取得二种倍数性组合。根据染色体数证实了杂种性。
Evans(1962)培养授粉后12-15天的Kura三叶草×Alsike三叶草的胚,拯救了四种倍数性组合和全部正反交。只 组合开花,是可育的。采用移植看护胚乳技术,取得了相同异种杂种。用Kura三叶草(母本)为看护胚乳,取得一种新倍数性组合,杂种都能开花。Rupert等(1977)用Kura三叶草×Alsike三叶草和T.montanum L.未成熟杂种胚取得愈伤组织,从前一杂交和从五倍体和三倍草体Kura三叶草再生植株。Richards等(1980)研究这些材料的子房培养。Rupert等(1980)取得了Kura三叶草×Alsike三叶草的胚培养产生的杂种。Alsike三叶草×T.michelianum的胚培养未得成功。首次拯救成功Kura三叶草×T.montanum和T.occidentale的杂种。
组合开花,是可育的。采用移植看护胚乳技术,取得了相同异种杂种。用Kura三叶草(母本)为看护胚乳,取得一种新倍数性组合,杂种都能开花。Rupert等(1977)用Kura三叶草×Alsike三叶草和T.montanum L.未成熟杂种胚取得愈伤组织,从前一杂交和从五倍体和三倍草体Kura三叶草再生植株。Richards等(1980)研究这些材料的子房培养。Rupert等(1980)取得了Kura三叶草×Alsike三叶草的胚培养产生的杂种。Alsike三叶草×T.michelianum的胚培养未得成功。首次拯救成功Kura三叶草×T.montanum和T.occidentale的杂种。
兹将其它三叶草培养程序汇综如表20-3。
表20-3 其它三叶草离体培养程序

a.未列出;根据已发表资料推断。
(4)百脉根 Niizeki等(1971)培养百脉根2品种和2个品系和L.caucasicus Kuper的花药。采用Miller,Bourgin和Nitsch(1967)和MS基础培养基+IAA,2,4-D,KIN和BA。以Miller+IAA和KIN或BA愈伤组织形成较好。8.8或23μM NAA和6.6或17.6μM BA再生茎叶最稳定。只有IAA+KIN组合上愈伤组织生根。不加生长调节剂培养基最适于茎叶生根。显微镜观察指出愈伤组织是从体细胞组织产生。约5%再生植株具有加倍染色体数,其余为体细胞染色体数。愈伤组织染色体有较大差异。离体小孢子未能培养产生愈伤组织或植株,虽曾观察到某种细胞分裂。
Tomes(1976)培养5个cvs.和一种种质的幼苗下胚轴,培养在含细胞分裂素和生长素培养基上4-6周后,愈伤组织转入含细胞分裂素培养基一或二次。观察到形态建成方面的栽培品种差异,每个品种诸基因型的60-98%再生植株。花药、子房和茎产生的愈伤组织反应相似。
Swanson等(1980)用品种Leo几种基因型培养在B5+MS浓度的CaCl2和MgSO4和4.5μM2,4-D建立了愈伤组织培养物。选择9种基因型的快和慢生长型愈伤组织,分别混合,混合随机选择的15种基因型的未经选择的对照愈伤组织。继代在加4.5μM或0.18mM2,4-D培养基上,每次继代间隔时间不同。快生长的愈伤组织经每隔3周继代7次后,比对照愈伤组织能耐较高2,4-D(0.18mM)。这种耐性机制,显现为诱导的,稳定的,与活体测验结果不同。从耐2,4-D愈伤组织和从细胞悬浮体生长在标准和增高浓度2,4-D上再生了植株。采用分生组织培养繁殖之。Phillips用品种Leo和耐2,4-D系(T-68)的已建成愈伤组织继续研究结果。取1年龄愈伤组织培养在:不加生长调节剂,单用0.22μM BA,和BA+0.45或0.23μM 2,4-D,0.29μM IAA或0.27μM NAA组合,测验茎叶和根再生。二者反应不同。以不加生长调节剂或单用BA效果最好。T-68反应比Leo为慢,但转入再生培养基,再生频率相当。4.5μM 2,4-D培养基未见分化,对较低2,4-D的反应中等。T-68对降低2,4-D浓度敏感性低于Leo。当二种愈伤组织培养在2,4-D逐步增高到0.18mM时,T-68的耐性较强特性,仅出现于很早的几次继代中和较低2,4-D。第三次转移,T-68耐性与Leo相当。培养在最高浓度2,4-D一个月后,二者生长受抑制,反应无差别。将芽移至0.22μM BA培养基产生了植株。在高浓度2,4-D选出Leo愈伤组织的再生植株,耐性高于Leo对照,但还次于T-68对照。
这种T-68活体和人工培养2,4-D反应间的正相关,提出T-68耐性机制,可能是2,4-D接合作用。分离Leo人工培养耐2,4-D有效选择正是90μM-0.18mM 2,4-D。与T-68对照相比较,以约65μM 2,4-D更有效。
Tomes(1979)用Leo的10个基因型的茎尖分生组织(直径约0.3mm)和茎节(长5mm)培养在B5+0.22μM BA和不加生长调节剂培养基上。在BA培养基上,茎叶繁殖较快约5倍。愈伤组织很少。有些茎叶培养物储存在2-5℃一月,存活率或平均长度无显着变化,可见适于长期冷藏。茎叶培养在无生长调节剂培养基诱导生根。每月茎叶数增高10倍。不少研究者采用Keim(1953)和Evans(1962)培养三叶草技术培养百脉根的胚。取得了百脉根×狭叶百脉根(L.tenuis Waldst.和Kit.)和巨形百脉根(L.pedunculatus Cav.)杂种。一般只有鱼雷期胚才能培养成功。DeLautour等(1978)采用看护胚乳技术拯救四倍体狭叶百脉根×百脉根杂种。由于胚已充分成熟,不需要胚乳移植。杂种部分可育。狭叶×巨形百脉根杂种,利用看护胚乳培养心形和鱼雷形胚成功。
百脉根培养程序综述如表20-4。
表20-4 百脉根离体培养程序

2.应用于作物改良 饲料豆科组织培养技术最直接应用于作物改良是茎尖分生组织培养消除病毒,产生合成栽培品种。无毒Tillman白三叶草亲本克隆和Kenstar红三叶草是成功之例。Tomes(1979)法可应用于百脉根无性系消除病毒。Parrott和Collins(1982)改进的Phillips和Collins(1979)和Collins和Phillips(1982)方法,适用于地中海、深红色、Zigzag和其它三叶草。这种技术产生的植株对病毒不是免疫的,限制了它的应用价值。无病毒母系有利于种子生产和保持优良合成栽培品种。
Phillips和Collins(1979)提出二倍体红三叶茎尖快速无性繁殖法。Skucinska和Miszke(1980)提出未成熟花序细胞无性系繁殖法。白三叶草和百脉根也有适当技术。二倍体红三叶草培养技术扩大应用于白、地中海、深红色,Zigzag和其它三叶草。可用较大茎尖。红三叶冠芽、白三叶草匍匐枝尖或百脉根茎节可选用。饲料豆科用插枝法虽常用于克隆繁殖,但组织培养繁殖率较快。
Cheyne等(1980)提出红三叶和白三叶草茎叶培养体长期冷藏法。Tomes(1979)证实了百脉根茎叶培养长期冷藏的潜力。二者都用标准茎叶繁殖程序产生培养体,冷藏在2-6℃,取得成功。
Phillips等(1982)采用一系列规定培养基,拯救红三叶草心形期杂种胚。调节未成熟胚的渗透压敏感性,和防制未熟发根(种根)(第一步)。继后培养条件,促进茎叶发芽和发育(第二步)。然后繁殖茎叶(第三步)和生根(第四步)。从只产生愈伤组织的胚也成功地取得植株再生。这些方法将适用于产生红三叶草远缘异种杂种。
采用规定培养基能产生饲料豆科种远缘杂种Rupert等(1980)培养白三叶草和有关种成功,支持着这种观点。Williams(1978,1980)和DeLautour等(1978)用看护胚乳技术产生某些三叶草和百脉根杂种。Keim(1953)和Evans(1962)和其它相对简化培养基,仅适用于关系接近种间杂种。
Phillips等(1981)首次在细胞水平上,用细胞选择法研究红三叶草磷素效率。初次试验从一个基因型再生了具有磷含量增高的饲草,含氮也增高。能否在大田条件下得以表达,以及传给后代,尚待研究。继后研究是有成效的。这类植株可用于改良饲草质量和肥效。这可能为培育具有充足遗传变异性群体提供依据,便于把优质特性转入栽培品种。
Swanson等(1980)在愈伤组织和细胞水平上选择百脉根2,4-D耐性。发现一个基因型在活体和人工培养对2,4-D反应有正相关,并再生了某种程度上2,4-D耐性有所增高的植株。可期在人工培养下细胞选择结合离体培养下表型轮回选择,将能产生2,4-D耐性显着增高的基础群体。利用这类群体培育新栽培品种,将对百脉根生产有巨大助益,由于能有效地控制宽叶杂草,和立苗期间可减少竞争。
3.关键变值和成功因子 取得人工培养最重要因子可能是供试基因型。Phillips等(1979)和Keyes等(1980)证实了红三叶草不同栽培品种和基因型对培养反应不同。其再生与基因型是关键,并已探索出最适于许多基因型的培养条件。Parrott等(1982)用许多三叶草种,Tomes(1976)观察百脉根植株再生,都指出基因型重要性。许多三叶草群体中再生频率,可用育种方法取得改进,如紫苜蓿之例。凡能用细胞选择法的异交种,这是重要的。
产生愈伤组织和细胞悬浮培养物,供试组织来源是重要因素。未成熟(组织化分化差)组织比成熟组织一般反应更快。分生组织源再生植株比非分生组织源更有效。生殖组织产生的培养体再生植株优于营养组织。但是,各种组织都能成功地建成培养体。
Gresshoff(1980)观察到三叶草对各种培养条件反应有某种程度的可塑性。许多学者采用相似培养条件。基础培养基是培养成功的重要因素。Murashige与Skoog(1962)在首创烟草研究中,提出改进盐类以取得最适愈伤组织生长。Linsmair与Skoog(1965)指出最适盐类成分需要相对少数维生素和有机成分。似乎随着愈伤组织培养成需要许多维生素和有机成分,最适盐类成分必需减少。Miller(1961)报道大豆愈伤组织培养改进的基础培养基;Gamborg等(1968)提出大豆细胞培养的改进培养基;Schenk与Hilderandt(1977)提出适于多数双子叶和单子叶种愈伤组织培养基。凡此已成为三叶草和百脉根的基础培养条件。Phil1ips等(1979)设计了培养红三叶草和某些其它豆科作物的改进的培养基。能取得生长更好和广泛适用于许多红三叶基因型。Skoog等的假说,支持着最适盐类组成,需要相对少量维生素和有机成分。采用最适基础培养基对红三叶草是重要的,为了细胞悬浮培养,分生组织顶尖培养和胚拯救要改变培养条件。
选用适当浓度的适宜生长调节剂,是取得特种培养反应的关键,尤以再生植株是如此。采用2,4-D是诱导体细胞胚胎发生和茎芽的有效关键。低2,4-D与ADE配合最适于产生体细胞胚胎发生。从高2,4-D+NAA和KIN转入无2,4-D加NAA和ADE能诱导茎芽形成。
用相对高PIC+细胞分裂素最适于愈伤组织和细胞增殖。中等浓度PIC+ADE能使有性心形胚成熟。未成熟有性胚对细胞分裂素要求与体细胞胚相同。低PIC+中等BA是有性和体细胞胚芽发育所需。低PIC和高BA时,芽增殖最快。用IAA生根最好。
分步培养红三叶草使培养取得成功。第一步,鉴定人工培养愈伤组织所需的基础营养。第二步,分生组织顶尖产生的芽生长和增殖方法。第三步,根诱导。尔后提出产生细胞悬浮培养和通过体细胞胚胎发生从愈伤组织和细胞悬浮培养体再生植株方法。
4.紫苜蓿 饲草(青刈饲料)是人们营养组成的最大给源,食物中占18%和总蛋白质的36%。反刍动物饲料中占60-80%。紫苜蓿(Medicago sctiva L.)是世界性最有生产力的饲草种。其起源中心在伊朗。现代品种的遗传差异性来自9个不同种质。就紫苜蓿育种言,它是很复杂种,在于同源四倍体遗传学,病虫害、多年生、必须昆虫传授,在产区以外地区生产种子,与Rhizobium共生固氮等。紫苜蓿是优质蛋白质,但缺蛋氨酸。其生产受到冬季低温和生长季多雨,易遭病害。
Saunders与Bingham(1972)首次报道离体培养紫苜蓿细胞和组织再生以来进展很快。包括长期培养,悬浮培养和原生质体产生细胞聚合体。Bingham育成二个品系:RegenS和RegenY。分别是紫花和黄花四倍体。还有二倍体克隆品系HG-2。Mitten等(1981)报道35地方栽培品种和早期新种材料具有人工培养再生潜力。前者代表着育种家所有的广泛种质源。Reisch等(1980)报道再生潜力是遗传的,可经轮回选择加以改进。
离体培养经体细胞胚胎发生控制紫苜蓿再生条件有三:外源生长调节剂作为生长素源的结构质量和浓度,外源细胞分裂素浓度和再生培养基中还原糖水平。
简言之,曾采用细胞群体的二步再生程序,培养在SH盐类+25μM NAA和10μM KIN。在此条件下,经培养在SH盐类+50μM 2,4-D和5μM KIN短时间后,产生具有高度胚再生能力的组织。不加荷尔蒙和NH4+25-100mM培养基,最适于再生。当诱导培养基含50μM KIN和5μM 2,4-D时,再生培养基NH4+12.5mM时,将可生根。NH4+高于25mM时,产生体细胞胚。再生最适条件因基因型而异。
(1)细胞培养物产生的原生质体再生体细胞胚。都用幼芽为原生质体源。原生质体制备和培养技术相似,生长调节剂都采用了2,4-D,NAA和KIN(表20-5)。
表20-5 原生质体培养用培养基

a.用NH4OH调节pH到5.5。
原生质分离和培养的条件的要求如表20-6。其条件较宽,能以支持原生质体生存、生长和植株再生。Johnson等(1981)从Regen S选得最适再生的基因型。Kao等(1980)提及基因型的影响。可以得出结论,从不同基因型的原生质体再生植株的最适条件,尚待鉴定。
表20-6 分离紫苜蓿原生质体的酶溶液

a.常用量的二倍母液。
Stavarek等(1980)报道交互处理顺序从长期培养紫苜蓿细胞产生植株。供试细胞系连续培养32个月。此外,用1%NaCl培养细胞进行抗性选择。指出再生启动时期需要高KIN27.9-100μM和低生长素以诱导生芽。转入无荷尔蒙培养基使形成叶和根。Walker观察长期培养RA3细胞系的再生潜力的损失或降低。一般这些系确能保持残余的再生植株能力,当用这些植株重建成细胞培养体时,常能恢复高频率再生。这种程序特别适用于种质保存。并提出再生潜力的损失,是这种细胞群体竞存性的非基因波迁。另一种情况,细胞的长期培养系可能具有不同遗传能力的不同类型。论及再生潜力损失时,这些可能性必须加以考虑。
Bingham等(1975)不仅是紫苜蓿再生的创始者,也是深入报道再生育种的学者。已知在品种中只有少数基因型能以人工培养再生。曾证实了紫苜蓿种质再生差。除品种Ladak,Turkestan和Norseman含有50-80%再生者基因型。Bingham等改进再生的育种,鉴定出5可育可再生克隆(基因型),其中4来自品种Saranac和1来自品种Dupuits。经随机互交,后代再筛选再生能力,经二次轮回选择,再生者基因型频率从12增到67%。Walker等(1978)发现采用改进的再生技术,Bingham材料的再生者基因型百分可增到67%,可能达到100%。这很重要:第一,证实了紫苜蓿离体培养再生的高遗传力;第二,肯定了紫苜蓿种质集团人工培养可再生性差。最后,加拿大品种Rambler,Roamer和Drylander产生的黄花再生者母系,与Flemish衍生者(Regen S)杂交,指出二者再生力的遗传控制相似。
Reisch等(1980)二倍体系紫苜蓿离体培养再生的质量遗传。认为受二个基因的质量特性。可是,分析是以相应重复试验归纳的百分数为准的子代基因型为基础,这种归纳的结果,并未考虑胚形成和植板的数量频率可能相当高或相当低。如能以供试细胞的每克鲜重产生的绝对胚数为数量基准,则能得出更合理解释。
Reisch等(1981)选择抗乙硫氨酸(蛋氨酸衍生物)紫苜蓿细胞系。有一个细胞系可溶蛋氨酸增高10倍,假定是蛋氨酸生产过程中酶的反馈控制改变的结果。其总游离氨基酸增43%,蛋白质氨基酸增40%。他测验蛋氨酸抗性培养体再生的25株的25细胞系,对乙硫蛋氨酸培养基的反应,只有7株产生的细胞系仍有抗性。可能是由于原始选系是抗和感细胞的混合体。另一种情况,离体培养产生的抗性,可能是由于基因表达的后生变化,再生植株时丢失。这些培养体再生植株出现许多变异形态类型。
Croughan等(1978)选择紫苜蓿耐盐细胞系成功。可耐1%NaCl,最适生长是0.5NaCl。无盐条件下生长差。Croughan等(1981)指出采用Stavarek等(1980)长期培养体再生植株技术,从耐盐细胞系取得再生植株。但尚未测验再生植株对盐的反应和遗传研究。
(2)二倍体在培育高度异质四倍体中的利用:
在二倍体水平上培育多倍体作物作为改进多倍体产物的方法并非新奇。Chase(1963)以“分析育种”名之。紫苜蓿是天然同源四倍体,适用于这种育种体系。分析育种包括三个主要步骤:a.把种质从四倍体转入二倍体水平,b.然后在二倍体水平上进行培育和选择,和c.把改进的二倍体种质转回四倍体水平。其优点是超脱着四体遗传复杂性,如需要大量群体以检测极少分离体,需要双重回交以鉴定杂合体,优先配对或双减数的可能性和数量不离开。
利用分析育种方案要有二种主要技术:有效地转移种质到二倍体水平的方法,和然后把改进的二倍体种质相对完整地转入四倍体水平的方法。第一,用二种方法把四倍体种质转入二倍体水平。一是4x和2x杂交后选取母性单倍体(2n=2x=16);二是利用倍数性水平桥杂交,先从4x和2x或2x和4x杂交产生三倍体(2n=3x=24),然后利用3x和2x杂交以产生二倍体,但3x和2x杂交结果常产生非整倍体(一般是三体)和二倍体。桥梁杂交法的另一缺点,是4x和2x继之3x和2x一轮杂交产生的二倍体,只含有约 四倍体种质,为此需经多次桥梁杂交,才能有效地渗入四倍体种质。
四倍体种质,为此需经多次桥梁杂交,才能有效地渗入四倍体种质。
4x和2x杂交产生单倍体是合宜方法,由于原始单倍体只具有四倍体亲本的基因,避免了多次杂交。原始单倍体一般雄性不育,单倍体×单倍体不可能。但是,2x单倍体能与2x野苜蓿杂交,产生含有50%栽培基因(来自栽培的四倍体种质)和50%“野生”基因(来自野苜蓿)的群体。继之用杂种与原始单倍体回交,取得具有50-98.5%栽培四倍体种质的二倍体群体。这些二倍体水平的栽培紫苜蓿群体,能与从其它四倍体种质产生的原始单倍体杂交,从四倍体水平渗入需要的种质。其主要缺点是单倍体产生频率低。平均每授粉1000 4x和2x杂交产生一个单倍体。当采用最好二倍体授粉者(M.glomerata的一个基因型)与同质基因(jp)(不进行1或数分裂后胞质分裂)四倍体母系杂交,授粉效率增高到每1000产生30单倍体。进一步改进技术,如运用花药或小孢子培养,增高从任何四倍体基因型产生单倍体的能力,将大大提高通过倍数性水平转移种质的效率。
取得把四倍体种质转入二倍体水平能力后,可在二倍体水平上进行培育和选择。一旦取得合于需要的改进的二倍体种质,目前已有许多方法把这种种质转回四倍体水平。一是用秋水仙素处理体细胞使染色体数加倍。二是利用二倍体亲本的2n(未减数)配子。也可采用倍数体间桥梁杂交,从4x和2x杂交产生的三倍体,与4x亲本杂交。最后,原生质体融合产生体细胞杂种,从原生质体再生紫苜蓿植株提供新途径。这些转移方法,在杂合体保留程度上有相当差异。秋水仙素加倍法是转移的最差方法,由于这是一种自交过程,由此四倍体产物只能是任何位点上的双等位基因的。桥梁杂交法也不可取,由于转移二倍体基因型是相对不变的。
种质转移的最理想方法是取二种无关的高度杂合二倍体的体细胞融合。原生质体再生植株虽已有可能,苜蓿属体细胞融合尚待证实。原生质体的再生植株也可能有赖于基因型,好像愈伤组织的再生植株;为此,在能以使任何二倍体原生质体融合和再生前,要进一步改进技术。
目前已有的通过倍数性水平种质转移的最合要求的技术是产生2n配子。2n配子具有孢子体染色体数。许多种发生低频率2n配子,认为它是植物进化的基本多倍体化机制。曼陀罗属玉米,茄属和苜蓿曾提出2n配子形成受单基因控制。
第一次减数分裂重建而形成2n配子,是从选择的二倍体的最大量的杂合性转入四倍体的最合要求的机制。通过这种重建(FOR)2n配子转移的杂合性量,从着丝点到第一个交换是100%,第一与第二个交换间为50%,和第二个交换以外是75%。紫苜蓿一般每个二价体有一个交叉,用FDR 2n配子,则可望有80%二倍体的杂合性得到转移。这种机制(通过不同倍数性水平转移种质)的显着概念,不仅能保持位点内杂合组合,同样也能保持位点间杂合组合。
紫苜蓿2n花粉形成的最近研究,指出2n花粉形成受单隐性基因控制,以rp名之。这种基因通过第一次(减数)分裂重建机制而形成2n花粉。初步产量比较试验,评价了从二倍体亲本形成FDR 2n花粉的4x-2x杂交家系与4x×4x杂交家系(4x亲本是用秋水仙素处理相当的2n花粉形成的二倍体产生的)。全部资料证实了前者优于后者,指出FDR 2n花粉在从二倍体的杂合组合转入四倍体子代的优越性。
在目前技术水平上,可利用2n配子以二倍体相对完整地把种质转入四倍体。但是,这种利用2n配子以合成最大杂合性四倍体品种的育种方案尚待研究。图20-1育种方案是利用2n卵和2n花粉以形成四倍体杂种。有意义的是产生2n配子植株也能产生n配子。同质rp二倍体植株产生2n花粉频率为4-56%,视基因型和环境而异。因此,形成2n花粉植株可保持在二倍体水平上,能在含有rp基因的群体中进行培育和选择。这种育种方案包括二种选择的和无关的2n花粉生产者与二种选择的和无关的2n卵杂交产生二倍体。结果产生2n花粉生产的子代,用于与2n卵生产者子代杂交,以形成高度杂合的四倍体群体。

图20-1 利用2n配子的育种方案
Phillips等(1982)改进上述方法,用于拯救未成熟杂种胚。最后,利用细胞选择法以产生变异体植株(Phillips等,1981)。当前要研究原生质体和亚细胞技术。逐步培养法作为红三叶典型系统,可应用于其它豆科种。
(二)培养程序
A.红三叶草培养程序
红三叶离体培养流程如图20-2,培养基成分如表20-7(基础培养基)和表20-8(生长调节剂)。详细培养程序述之如下。一切操作采用标准无菌技术,在超净台上进行。

图20-2 红三叶离体培养能力和培养基顺序
表20-7 L2基础营养培养基及其改进的成分,用于红三叶人工培养
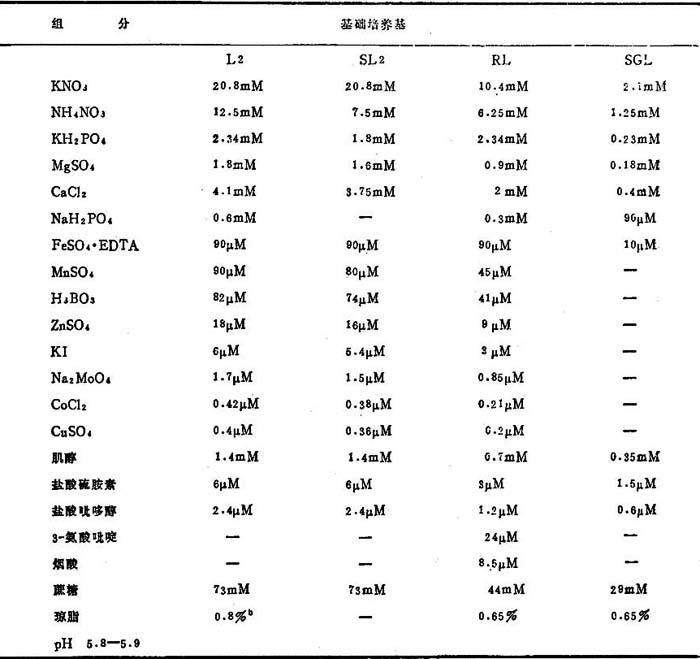
a.生长调节剂成分见表6。
b.从细胞悬浮培养体取得愈伤组织克隆,要降低到0.3-0.6%。
1.外植体制备(包括幼苗发芽)
(1)幼苗发芽
①用中号沙纸将种了分层播种。
②种子放在双层纱布内,加短细索以便转移。
③种子浸入95%乙醇,5min。
④种子转入饱和次氯酸钙溶液15分钟。很清洁种子只要用40%漂白粉(2%次氯酸钠)15min。
⑤用无菌去离子蒸馏水淋洗种子5min,3次以上。
⑥种子分粒放在SGL培养基上。培养和保持在25℃,低到中等光强。
⑦1-2周内应能发芽。选取未污染正常种子为外植体。每种幼苗代表一种基因型。
⑧切取子叶、上胚轴、下胚轴和/或根,各别接种在适宜培养基上,例如L2诱导产生愈伤组织。
(2)其它植株部分为外植体
①新采取器官或组织,保持在湿雾中,备用。用水或肥皂水淋洗材料,以除去大颗粒尘埃。例如,取1-3cm冠部或芽,切取分生组织顶尖,从雌蕊切取小花或胚等。
②材料放入40%商品漂白粉(2%次氯酸钠),5-8min。可加一滴肥皂水。有些组织如大田取样的成熟叶柄,可用饱和次氯酸钙溶液5-8min。
③用无菌、去离心、蒸馏水淋洗材料至少5次。如果用次氯酸钙消毒,加洗一次。
④从消毒的材料切取目标外植体(如分生组织顶尖、胚等),各个地接种在适宜培养基上。
2.茎尖分生组织培养和无性繁殖
(1)从消毒的材料切取分生组织顶尖,包括分生组织帽盖和1或2叶原基,接种在LM8培养基上。
(2)培养和保持在25℃,低光强。4-6周内,约有3/4外植体产生1个以上茎叶。
(3)茎叶数增多,按下节快速克隆繁殖所述方法诱导生根。
(4)应进行寄主植物检测和血清学测验,以鉴定那些植株无病毒。应约2/3无之。
3.快速无性繁殖程序
(1)适当大小的茎叶或冠芽接种和保持在LM8上,详见消除病毒第二步。
(2)每月继代在LM8,取得茎叶增加4-10倍。用小块茎叶(3-6)转入新鲜培养基,繁殖最快。
当将用个体茎叶继代时,茎叶数增加常有滞后期。
(3)培养在LM8时,有些基因型在茎叶基部可能产生愈伤组织。巧妙地调整生长素和、或细胞分裂素浓度,以取得最适繁殖率和愈伤组织形成最少,可能是必要的。
(4)据于其他学者的研究。培养在LM8的茎叶培养物,或可储存于2-6℃至少1或2年,成活率无明显损失。
(5)茎叶生根见下节。
4.拯救未成熟杂种胚
(1)人工授粉是否去雄视母本亲和性体系而定。例如T.sarosiense×红三叶不需要去雄,由于前者自交不亲和。由于异种配合力不同,有必要鉴别亲本无性系。
(2)T.sarosiense×T.pratense授粉后14-19天采集雌株小花。最适采取时间视杂交组合而定。
(3)小花消毒见外植体制备,包括幼苗发芽。
(4)每小花取未成熟胚。T.sarosinse×T.pratense取心形期胚。
(5)未成熟胚各个地接种在LIH上,8-14天,以防种子根的过早发芽,以备胚成熟。在此步骤中,T.sarosiense×T.pratense约20%胚能存活。球形、心形和鱼雷形期胚生长反应随之有所改进。培养体保持在25℃,低光强。
(6)第五步再生前,将胚转移到LSP2培养基,以促进茎叶发芽和发育。2-4周内,T.sarosiense×T.pratense胚约有一半产生茎叶。
(7)在分生组织茎尖培养体和克隆繁殖中,杂种茎叶数增多。由于每个杂种胚代表着潜在的不同F1系,鉴别克隆有重要性。
(8)如诱导体细胞胚胎发生和植株再生节所述方法,处置第6步期间只产生愈伤组织的胚,以愈伤组织取得杂种植株。
(9)运用遗传形态标志、染色体数和/或核型,和/或生化特性验证拯救的植株的杂种性。
5.诱导愈伤组织和增殖
(1)将制备的外植体,各别接种在L2上。
(2)培养体保持在25℃、低或中等光强,3-4周内应形成愈伤组织。
(3)愈伤组织保持和繁殖在新鲜L2培养基上,每月继代一次。选择最完好,旺势愈伤组织区块,以利无限增殖。
(4)将1-3m1悬浮体转入L2含降低浓度的琼脂(表20-5),从悬浮培养的细胞产生愈伤组织克隆4-6周内发生。按照上述第3步增殖之。
表20-8 L2及其改进培养基生长调节剂成分(用于红三叶草离体培养)

a.基础培养基成分见表5。
b.气化加入溶液。IAA母液存放冰箱内。
c.溶成钠盐,在调整盐分子量后计算克分子量。
d.溶于1.0NNaOH,用H2O加到母液最后溶液体积。
(5)任何时期选取愈伤组织,按照诱导体细胞胚胎发生和植株再生节所述处置。愈伤组织可保留形态建成潜势1-2年。植株再生频率视基因型、组织来源和培养体年龄而定。
6.细胞悬浮培养
(1)选出的组织外植体直接按种在SL2,供细胞增殖和从剥落细胞启动悬浮细胞。将小块松脆愈伤组织转入SL2,悬浮细胞启动最快。约取0.5g愈伤组织接种在12ml培养液中。
(2)每周加入新鲜SL2。最初2次继代,以1∶1稀释培养体。一旦产生单细胞大群体和细胞小合体,取约5m1悬浮物移入约25ml新鲜培养基。根据培养物中细胞生长速率和所需的细胞群体密度,变动继代稀释或接种比率。常用密度为1×106细胞/ml。
(3)培养物振荡110pm,暗培或低光强。标准培养温度为25℃。
(4)在系列继代期间,悬浮体过筛网孔75μm或用狭孔吸移管,以利保持培养物中单细胞和小聚合体。并非全部继代所需。
(5)采用这些程序,悬浮细胞可无限期保持。用上述愈伤组织诱导和增殖节取得愈伤组织无性系。当供试基因型适合时,形态建成可保持1或2年。
(6)采用在培养液中引入或除去适当组分,以建立选择条件,或提供适合环境条件,进行细胞选择。选择期间采用系列继代程序。这将有助于消除产生交叉饲喂细胞的可能性,后者不适用于这种选择条件。
7.诱导体细胞胚胎发生和植株再生
(1)愈伤组织,包括从细胞悬浮培养物诱导产生的,接种在LSE上。以大聚合体比小为好。培养体保持在25℃,低-中等光强。可能需要一种光周期。
(2)4周内开始从愈伤组织出现体细胞胚。每月继代在LSE一次,取得更多体细胞胚。经反复继代后,更多基因型培养物启动体细胞胚胎发生。如果在6次继代中,不发生反应,一般不会产生体细胞胚胎再生。
(3)培养在LSE期间,某些胚发育成茎叶。许多生根。将未生根胚簇或各个地转入LSP2。为了从更多胚发育成茎叶,可能需要反复继代 LSP2上,每月一次。
LSP2上,每月一次。
(4)体细胞胚培养在分生组织茎尖培养和克隆繁殖节所述程序,产生的茎叶数增多。充分发育的体细胞胚(有茎叶和根)也可从活体建成,程序见下列移栽入土长成植株一节。
(5)采用Beach和Smith(1979)法也能再生植株。愈伤组织培养在加10μM 2,4-D,10μM NAA,和10μM KIN培养基上,每月继代,或2次,以诱导茎芽发生。然后把愈伤组织转入加10μM NAA和15μM ADE,每一月或更长继代一次,以诱导从芽发育成茎叶。可用B5,SH或L2为基础培养基。生根程序如下。
8.茎叶生根
(1)人工培养红三叶产生的茎叶,各个地接种在RL上。培养体保持25℃,低光强,一种光周期。
(2)2-4周内,许多茎叶生根。在新鲜RL上再培养一月,促进根和植株发育。
(3)有些基因型产生的茎叶,在RL上不生根。可把这些茎叶放在无菌自来水的烧杯中。盖以薄膜(如石蜡膜),膜上穿若干小孔。保持在高湿度下时,以利空气交换。通常在1-2月内可望生根。每周或二周要换水一次。
(4)生根移栽方法如下。
9.移栽入土建成植株
(1)除去再生植株上的琼脂。用镊子和温水轻度淋洗。
(2)植株栽在装有土、泥炭和洗过的蛭石(1∶1∶1体积)的盆钵。也可用其它土混合物。根尖必需向下。当需要这些植株固氮时,可接种Rhizobium trifolii。
(3)必须放在高湿度下约2周。可用塑料篷或人工气候箱或室。薄雾架也可。
(4)盆栽植株必须有规则浇水。不让土干,以防凋萎。也不可过湿,以防猝倒病。
(5)经2周后,大多数植株可适应正常温室条件。可移栽大田。
B.紫苜蓿离体培养程序
1.愈伤组织离体培养程序
①SH基础培养基+25μM NAA、10μM KIN(SHNAA/KIN培养基),对愈伤组织生长优于B5或Blaydes培养基。加选择的生长调节剂未见最速生长。但在此培养基上培养2年以上,保持高频率细胞再生植株。
②培养条件:25和30℃,不需光照。
③外植体源:任何部位均可在SHNAA/KIN培养基上形成愈伤组织。曾测验过根、茎、叶身、叶柄、子叶、子房和花药组织。任何部位产生的愈伤组织都能再生植株。
④取得外植体:生长旺盛阶段的幼组织为好。
⑤漂白粉用水稀释50-70%消毒10min。
⑥用无菌水充分淋洗外植体组织。
⑦接种在琼脂固化(0.8%)SHNAA/KIN培养基,可用培养皿或培养试管。
⑧光或暗培。
⑨启动后每隔14-21天继代一次。
2.植株再生 无论用于培养细胞的生长条件如何,用高2,4-D短时间处理,随之除去,可相当大地增高再生频率。
(1)培养基 SH+25-50μM 2,4-D和1-10μM KIN以诱导生胚,随之用SH+ 是相宜的。其它还原氮也取得成功,如YE和N-Z胺R。
是相宜的。其它还原氮也取得成功,如YE和N-Z胺R。
(2)从相宜给源取得细胞。用75-300mg鲜重/板或30mg鲜重/ml分别转入固化或液体培养基。
(3)3-4天后收集细胞(无论固体或液体培养基中的细胞,可分散在液体培养基中,以便于接种培养板)。
(4)接种再生板,密度为75mg鲜重/ml培养基。
(5)光培 转移后18-24天最适于再生。
(6)取得再生植株,再生后3周,把胚分开转入新鲜再生培养基。
(7)人工培养下过早发芽的胚,转入 和29μMGA3,以增强继续生长和生根。
和29μMGA3,以增强继续生长和生根。
(8)当再生植株高3-5cm时,可移栽于温室。
3.原生质体分离与培养
(1)培养基 分离混合液组成见表20-6。
(2)常用叶制备原生质体。先洗、消毒,质壁分离溶液预处理,加入酶液。常撕去下表皮以助消化。10-25ml酚混合培养基加1g叶。
(3)轻度振动消化液4-16h后释放出原生质体。
(4)用尼龙筛予过滤以收集原生质体,离心后,漂浮在蔗糖(21%w/v)或其它浓材料中。
(5)原生质体培养,常用Kao与Wetter(1977)培养基+不同生长调节剂,包括2,4-D和细胞分裂素。诸荷尔蒙用量为1-5μM。
原生质体生长受植板密度的影响。应指出文献报道,都是从叶肉组织分离原生质体的。
(三)展望
研究结果指出活体和离体培养红三叶草某些生长特性表现正相关。尤其可用离体培养自交一代的纯系的生长和形态建成作为指数:农艺产量、成熟期和生存性的潜在状态。如能实现,大有助于例如把多年生种的长寿性掺入红三叶草。这类相关可用于离体培养筛选特性,如大田幼苗长势。
采用细胞培养技术进行基础和开发研究前途光明。人工培养下细胞操作技术已全部具备,但至今仅应用少数紫苜蓿种质。深入研究人工培养再生和培养的机制或运用遗传方法控制再生和培养原则,可能扩大应用一系列种质。
细胞和组织选择抗病性方法,为改进饲料豆科提供巨大潜力。带有产生毒素的病害,最适于运用浓缩毒素或病原菌培养体过滤物进行细胞选择。可用人工培养方法,在分离群体内,筛选抗病性。几种豆科种的初步研究,建立了人工培养和活体产生植毒素间的正相关。证实着饲料豆科可进行细胞水平上的生化选择。细胞选择法也能用于产生特种氨基酸的超量生产,和改进耐各种不利条件的特性,如极端温度、极端潮湿环境,高盐浓度(灌溉水和土壤)和土壤重金属。
冰冻生物学方法可用于饲料豆科遗传变异性的长期保存。优点在于储存时间相当长,可减省材料处理。茎尖是最适用材料。
离体培养产生单倍体植株,是饲料豆科育种法的革命。花药或胚珠培养可用于产生单倍体。单倍体和双单倍体纯系提供有效自交方法,产生异交种的单交或双交杂种栽培品种的方法。
此外,原生质体体细胞融合产生远缘异种杂交。已提出了分离和培养白三叶原生质体方法,不久将来将能应用于红三叶,由于已具备了全部基础技术学。体细胞融合提供潜在可能,以代替胚拯救技术,以取得新远缘杂种组合。原生质体技术的进展,将为研究细胞器和亚基因组操作和分子遗传工程提供基础。
【参考文献】:
〔1〕Carnhan,H.L.and H.D.Hill 1961 Cytology and genetics of forage grasses。Bot.Rev.27∶1-162.
〔2〕Heath,M.E.,D.S.Metcalfe and R.E.Barnes 1973 Forages∶The Science of Grassland Agriculture.3rd ed.Iowa State Ulniv.Press,Ames.
〔3〕Larkin,P.J.and W.R.Scowcroft 1981 Somaclonal Variation-Anovel source ofvari ability from cell cultures for plant improvement.Theor.App.Gonct,60∶197-214.
〔4〕Schenk,P.J.and A.C.Hildebrandt 1972 Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell caltures,Can.J.Bot.50∶199-204.
〔5〕Thomas,E.,P.J.King and I.Potrykus 1977 Shoot and embryv.like structure formation from cultured tissues of Sorghum bicolor.Naturwissenschaffen 64∶587.
〔6〕Brenneman,F.N.and A.W.Galston 1975 Experimentson Cultivation of protoplasts and calli of agriculturally important plants.1.Oats(Avena Sativa L.).Biochem.Physiol.Pflanz.168∶453-471.
〔7〕Cummings,D.P.,C.E.Green,and D.D.Stuthman 1976 Callus inductionand plantregeneration in oats.Crop Sci.16:465-470.
〔8〕Flores,H.E.,R.Kaur-Sawhney and A.W.Calston 1981 Protoplasts as vehicles for plant propagation and improvement.In∶Advances in Cell Culture(K.Maramorosch,ed.)pp.241-279,AcademicPress,New York.
〔9〕Galston,A.W.and K.Kaur-Sawhney 1980 Polyamines and plant cells.What’s New Plant Physiology,11∶5-8.
〔10〕Loerz,H.,C.T.Harms,and I.Potrykus 1976 Regeneration of plants from callus in Avena sativa L.Z.Pflamzcnziiecht.77∶257-259.
〔11〕Dunstan,D.L.,R.C.Short,H.Dhaliwal and E.Thomas 1979 Further Studies of plantlet production from cultured tissue of Sorghum bicolor.Protoplasma 101:355-362.
〔12〕Green,C.E.and R.Phillips 1975 In vitro Plant regeneration from tissue cultures of maize.CropSci.15∶417-421.
〔13〕Lu,C.Y.,V.V asil and I.K.Vasil 1981 Isolation and Culture of protoplasts of Panicum maximum Jacq.(Guines grass)∶Somatic embryogenesis and plantlet formation.Z.Pflanzenphysiol.104∶311-318.
〔14〕Vasil,V.and I.K.Vasil 1980 Isolation and cultrre of cereal protoplasts,Part2.Embryogenes and plantlet formation from protoplasts of Pennisetum american umn Theor.Appl.Genet.56∶97-99.
〔15〕Vasil V.1982 The ontogeny of somatic embryos of Pennisetum americanum(L.)K.Schum.I.In:caltured immature embryos.Bot.Gaz.143∶454-465.
〔16〕Bingham,E.T.1980 Maximizing heterozygosity in autotetraploids.In∶Polypl-oidy Biological Revevance(W.H.Lewis.ed.)pp.471-489,Plenum Press,New York.
〔17〕Hurley,L.V.D.M.Kantz and J.W.Saunders 1975 Breeding alfalfa Which regenerates from callus tissue culture.Crop Sci.15∶719-721.
〔18〕Kao,K.N.and M.R.Michayluk 1980 Plant regeneration from mesophyll protoplasts of alfalfa.Z.Pflanzenphysiol.96∶135-141.
〔19〕McCoy,T.J.and E.T.Binghim 1977 Regeneration of diploid alfalfa plants from cells grown in suspension culture.Plant Sci Lett.10;59-66.
〔20〕Walker,K.A.and S.J.Sato 1981 Morphogenesis in callus tissue of Medibago sativa.The role of ammonium ion in somatic embryogenesis.Plant cell,Tissue and Organ Culture.1∶109-121。