亚硫酸盐溶液的成分和性质
出处:按学科分类—工业技术 轻工业出版社《制浆造纸手册第五分册酸法制浆》第124页(8061字)
亚硫酸盐法制浆厂用来蒸煮木材等纤维原料的药剂是含有SO2、MHSO3、MSO3、MOH等成分的水溶液,通称为亚硫酸盐溶液(或蒸煮液)。其中M代表金属离子,或称盐基,一般为钙、镁、钠或铵。
SO2在溶液中和水结合成亚硫酸(H2SO3),但一部分SO2仅溶于水而不和水结合。假定0℃时SO2成H2SO3状态存在的数量为100%,则在其他温度下溶液中H2SO3的数量为:

1.亚硫酸盐溶液的成分
亚硫酸盐溶液的化学成分用通式表示如下:
XH2SO3+YMHSO3+ZMSO3+WMOH
生产上以下列含量来表示亚硫酸盐溶液化学成分的特性:
(1)化合酸(C.A.)
系指酸液中与盐基结合成亚硫酸盐形式存在的SO2,以100毫升酸液中化含SO2克重计。
(2)游离酸(F.A.)
系指酸液中未与盐基结合成亚硫酸盐形式的SO2。以100毫升酸液中游离SO2克重计。
(3)总酸(T.A.)
化合酸和游离酸之和。
不同情况的举例说明:
当酸液中除与盐基结合成亚硫酸氢盐形式存在的SO2外,还有较多的H2SO3时(以钙盐为例,亦可用于其他盐基),其图解示意如下:

具有这种组成的酸液的pH值约1~3。酸液中的游离酸除与化合酸结合成亚硫酸氢盐之外的那部分称为过剩(或真正)游离酸或溶解SO2(F),即F=F.A.-C.A.。
当酸液中全部是亚硫酸氢盐(即F.A.=C.A.)时(以镁盐为例,亦可用于钠、铵盐基):

具有这种组成的酸液的pH值约在3~5。此时T.A.等于真正化合酸。
当酸液中除亚硫酸氢盐外,还有亚硫酸盐时(以镁盐为例,亦可用于钠、铵盐基):

具有这种组成的酸液的pH值约在5~6。由于亚硫酸钠和亚硫酸铵的溶解度很大,因此酸液可大部或全部是亚硫酸盐成分,此时酸液的pH值可大于5~6,甚至达到9左右。因此钠、铵称为可溶性盐基,而镁因其亚硫酸盐的溶解度不大而称为半溶性盐基
呈亚硫酸氢盐形式以外的亚硫酸盐,称为过剩亚硫酸盐(m),m=C.A.-F.A.。
(4)酸比(R)
化合酸与游离酸之比称为酸比,R=C.A./F.A.。
当用含有盐基的水溶液(或悬浊液)吸收二氧化硫后制成的亚硫酸盐溶液称为原酸(或塔酸)。当原酸吸收蒸煮过程中的放气产物和回收的部分蒸煮液后称为蒸煮酸,此时酸液中除含有化合酸和游离酸等成分外,还含有:与有机物作不坚固结合的(缓结合的)SO2;与有机物作坚固结合的SO2(木素磺酸和糖磺酸);有机酸(醋酸和蚁酸);还原物(主要是糖);以及硫代硫酸盐和多硫酸盐。
2.SO2的溶解度
(1)SO2在水中的溶解度
SO2属于中等不溶解性气体。在水中SO2的溶解度可按下列公式计算:

式中 x——SO2在水中的含量,%;
K——SO2在气体中的含量,%(体积);
p——总压力,毫米汞柱:
t——温度,℃。
(2)SO2在Ca(HSO3)2溶液中的溶解度
当溶液中存在亚硫酸氢盐时,由于HSO3-增加,SO2的溶解度降低。
SO2在Ca(HSO3)2溶液中的溶解度可按下式计算:

式中 x——SO2在Ca(HSO3)2溶液中的溶解度,%;
K——在气体中SO2的体积%;
p——总压力,毫米汞柱;
1.0363t——见表6-2-51;
R——常数,0.89;
C——CA,%
R2C值列于表6-2-55。
表6-2-51 局部阻力系数值ξ

表6-2-52 系数1.0363t值


图6-2-28 决定水中SO2浓度的列线图
表6-2-53 在大气压力下SO2在水中的溶解度

表6-2-54 在不同温度下SO2和水的蒸汽压



图6-2-29 SO2在水中的溶解度

图6-2-30 SO2水溶液的蒸汽压
表6-2-55 系数R2C值

表6-2-56 大气压力下100%SO2在Ca(HSO3)2溶液中的溶解度



图6-2-31 在20℃和大气压力下以饱和炉气制成的原酸中总SO2和化合SO2的比例

图6-2-32 在25℃和大气压力下以饱和炉气制成的原酸中总SO2和化合SO2的比例

图6-2-33 在30℃和大气压下以饱和炉气制成的原酸中总SO2和化合SO2的比例

图6-2-34 在不同的温度和压力下在亚硫酸氢盐溶液中(0.9%CaO)100%SO2的溶解度

图6-2-35 在不同的温度和SO2浓度下亚硫酸盐药液(0.9%CaO)的平衡状态
3·H2SO3+Ca(HSO3)2溶液的性质
(1)H2SO3的离解常数

根据上述离解常数,计算在常温下不同组成的酸液pH值:

上述结果绘于图6-2-36。

图6-2-36 亚硫酸盐溶液的离子浓度和pH值之间的关系
亚硫酸溶液的解离平衡常数随温度的提高而降低,可由下式计算:

式中 K1——H2SO3第一级解离平衡常数:
T——绝对温度,°K。
不同温度下,亚硫酸溶液的K1和pH值(计算值和测定值)的对比关系列于表6-2--57。
表6-2-57 亚硫酸溶液的K1、pH值和温度的关系

表6-2-58 亚硫酸溶液的组成与各离子浓度及冷热pH值的关系

(2)溶液的酸度
原酸的pH值取决于游离酸在总酸中所占的百分数。蒸煮酸中由于含有一部分有机酸,因此其pH值较组成相同的原酸为低。
表6-2-59 0℃时原酸的pH值
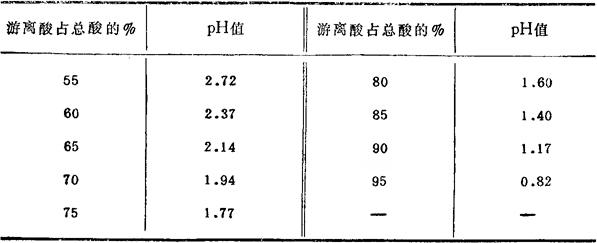
(3)溶液的比重
原酸的比重与酸液组成的关系可用下式表示:
d=1+0.0051(a+3b)
式中 d——15℃时酸液的比重;
a——酸液中总酸浓度,%;
b——酸液中CaO含量,%。
(4)溶液的电导率
原酸的电导率与总酸浓度有关,而与盐基的含量几乎没有关系。
(5)溶液的稳定性
溶液中的SO2和亚硫酸氢盐当和氧气接触时,则发生氧化反应而生成硫酸和硫酸钙:
2H2SO3+O2→2H2SO4
2Ca(HSO3)2+O2-→2CaSO4+2SO2+2H2O
上述反应在贮酸槽两相接触界面上很容易发生。当酸液表面有一层亚硫酸油(异丙基甲苯,或称聚伞花素)、煤油或其他油层时,可防止酸液和空气接触以提高它的稳定性。
表6-2-60 原酸的比重与酸液组成的关系

亚硫酸氢盐溶液较二氧化硫水溶液氧化得快。亚硫酸氢钙对于氧化较亚硫酸氢钠尤其是较亚硫酸氢镁为稳定。
在低温时(<30℃),糖类能使亚硫酸对氧化剂作用的稳定性增强;而温度高时则相反,稳定性降低。
纯净而冷的酸液如不与空气接触,则在很长时间内其成分可保持不变。但当酸液中存在Cu、Se、As2O3、Fe2O3等悬浮物和溶解的杂质时,这些物质对氧化反应有催化作用,而使酸液的稳定性显着降低。
表6-2-6120℃时原酸的电导率

提高温度、紫外线照射、通过电流等都能降低酸液的稳定性,此时催化剂呈现更强烈的作用。
在无氧存在时,酸液中的SO2和水之间发生氧化-还原过程,生成硫酸和元素硫。

亚硫酸氢盐溶液对这个过程的反应为:
3NaHSO3=NaHSO4+Na2SO4+S+H2O
亚硫酸氢钙仅在含有过量的SO2时才存在(表5-2-62)。当无过剩的SO2时,亚硫酸氢钙分解成亚硫酸钙、SO2和水,前者因在水中的溶解度很低而析出。
表6-2-62 大气压力下单亚硫酸盐沉淀时原酸的成分


当增加过剩SO2的含量时,亚硫酸氢钙的分解温度提高。
4.Mg(HSO3)2+MgSO3溶液的性质
(1)溶液的比重
在15.5℃时,酸液比重与总酸及亚硫酸盐含量m之间的关系如下式:
d=0.9954+0。0064m+0.0114T.A.
上式适用范围:T.A.为1.8~8.0%;m(过剩MgSO3以SO2%计)为0~1.2%。根据上式的计算结果列于表6-2-63。
表6-2-63 亚硫酸氢镁溶液的比重

(2)溶液的粘度
溶液的粘度μ与温度、T.A.及m的关系(图6-2-37)可用下式表示:

图6-2-37 亚硫酸氢镁溶液的粘度
1-水 2-T.A.1.37% 3-T。A.2.65% 4-T.A.5.22% 5-T.A.7.74%
μ=-0.72326+3.60177×10-6(t-197.5)2+9.73065×10-4(T.A.t33.122)2-3.13162×10-4(t)(T.A.)+0.03006m+0.00180S,厘泊
式中 S为硫酸盐中的硫对总硫的重量%,t为华氏温度。
(3)溶液的电导度
电导度是指酸液的单位电势梯度在单位时间内通过单位面积的电量。溶液的电导度(图6-2-38)可用下式表示:

图6-2-38 亚硫酸氢镁溶液的组成和电导度(25℃)的关系
K×10-4=0.16450331十0.14947439(m)+0.8473771(T.A.)-0.03297562(T.A.)2毫姆欧)
(4)溶液的酸度

图6-2-39 亚硫酸氢镁溶液的pH值
亚硫酸氢镁溶液的组成和pH(25℃)值的关系如图6-2-38。当T.A.=2C.A.,也就是酸液的成分全部是Mg(HSO3)2时,pH值范围为3.5~4.5。
在一般情况下,酸液的pH值都在室温下进行测定,温度上升后,不同组成的酸液的pH值变化情况如图6-2-40。

图6-2-40 亚硫酸氢镁溶液的pH值和温度的关系
〔0.315N Mg(1.01%C.A.)〕
不同盐基的亚硫酸氢盐溶液的pH值随温度上升而提高的数值如下:

上述数字说明,在常用的几种盐基的亚硫酸氢盐溶液中,亚硫酸氢镁溶液的pH值随温度上升而提高的数值最小,亚硫酸氢钠最大,因此蒸煮浆的得率最高。

(5)SO2分压
亚硫酸氢镁溶液上SO2分压的计算公式:

或: (毫米汞柱)
(毫米汞柱)
式中 F——游离酸FA,%;
m——MgSO3含量(以SO2表示),%;
T——酸液温度,°K。
镁盐基亚硫酸溶液上SO2分压比钙盐基低得多(图6-2-41),因此在生产Mg(HSO3)2溶液时,可以利用低浓度SO2的气体。

图6-2-41 钙镁盐基亚硫酸溶液SO2分压
在50℃时亚硫酸氢镁溶液的SO2等压线(图6-2-42)。图解示例:在Mg(HSO3)2线上方F.A.>C.A.;下方C.A.>F.A.,即溶液中有过剩MgSO3。横坐际表示C.A.,斜主线表示T.A.,曲线为SO2等压线。

图6-2-42 镁盐基亚硫酸溶液SO2等压线
例1:查5%T.A.2.5%C.A.的Mg(HSO3)2溶液的SO2分压。从图6-2-42查5%T.A.,2.5%C.A.与Mg(HSO3)2线三线的交点①,沿曲线查出SO2分压为20毫米汞柱(相当于与SO2炉气浓度2.64%相平衡)。
例2:查5%T.A.,m为0.2%时溶液SO2分压。从图6-2-42上5%T.A.斜线与0.2%(C.A.-F.A.)线相交于点②。沿等压线查出SO2分压为4毫米汞柱(相当于SO2炉气浓度0.66%相平衡)。
例3:查5%T.A.,F为0.4%时溶液SO2分压。从图6-2-42上5%T.A.斜线与0.4%(F.A.-C.A.)线相交于点③,沿等压线查出SO2分压为100毫米汞柱(相当于与SO2炉气浓度13.2%相平衡)。
(6)MgSO3的溶解度
具有3个结晶水和6个结晶水的亚硫酸镁在水中的溶解度见表6-2-64和表6-2-65。在不同温度和总酸浓度时MgSO3的溶解度见图6-2-43。
表6-2-64 MgSO3.3H2O在水中的溶解度

表6-2-65 MgSO3·6H2O在水中的溶解度

表6-2-66 不同盐基的亚硫酸盐溶解度


图6-2-43 在不同温度和总酸浓度时MgSO3的溶解限度